
 ,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.
,该氧化物与水反应的离子方程式2Na2O2+2H2O=4Na++4OH-+O2↑.分析 原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,M元素与X同主族,与W同周期,则M为Na,
(2)非金属性越强,氢化物越稳定;
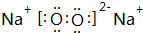
(3)Na2O2由钠离子与过氧根离子构成,与水反应生成NaOH与氧气;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu越稀硝酸反应得到硝酸铜、NO与水;
(5)由H、N、O、S四种元素组成的一种离子化合物A,为铵盐.
①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,即氨气为2mol,即1molA含有2mol铵根离子;②A能与盐酸反应产生气体B,该气体能与氯水反应,B为二氧化硫,可推知A为亚硫酸铵,二氧化硫有氯水反应得到HCl与硫酸;
(6)由H、N、O、S和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水.向C的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色,说明C中含有Fe2+和NH4+,另取少量C的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解,说明C中含有SO42-,结合C的相对分子质量和结晶水个数判断.
解答 解:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素,M元素与X同主族,与W同周期,则M为Na,
(1)由上述分析可知,M为Na元素,故答案为:Na;
(2)非金属性O>S,故氢化物越稳定H2O>H2S,故答案为:H2O;H2S;
(3)Na2O2由钠离子与过氧根离子构成,电子式为 ,与水反应生成NaOH与氧气,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
,与水反应生成NaOH与氧气,反应离子方程式为:2Na2O2+2H2O=4Na++4OH-+O2↑,
故答案为: ;2Na2O2+2H2O=4Na++4OH-+O2↑;
;2Na2O2+2H2O=4Na++4OH-+O2↑;
(4)由H、N、O、S四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,该酸为HNO3,Cu越稀硝酸反应得到硝酸铜、NO与水,反应离子方程式为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,
故答案为:3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑;
(5)由H、N、O、S四种元素组成的一种离子化合物A,为铵盐.
①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体,即氨气为2mol,即1molA含有2mol铵根离子;②A能与盐酸反应产生气体B,该气体能与氯水反应,B为二氧化硫,可推知A为(NH4)2SO3,二氧化硫有氯水反应得到HCl与硫酸,反应离子方程式为:SO2+Cl2+2H2O=4H++2Cl-+SO42-,
故答案为:(NH4)2SO3;SO2+Cl2+2H2O=4H++2Cl-+SO42-;
(6)由H、N、O、S和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水.向C的溶液中加入过量浓NaOH溶液并加热,产生白色沉淀和无色有刺激性气味的气体,白色沉淀迅速变为灰绿色,最终变为红褐色,说明C中含有Fe2+和NH4+,另取少量C的溶液,向其中加入过量BaCl2溶液时产生白色沉淀,再加入稀盐酸沉淀不溶解,说明C中含有SO42-,结合C的相对分子质量和结晶水个数可知C的化学式为(NH4)2Fe(SO4)2•6H2O,
故答案为:(NH4)2Fe(SO4)2•6H2O.
点评 本题综合考查位置结构性质关系,明确元素的种类为解答该题的关键,注意把握相关物质的性质,侧重于物质的性质以及化学式的推断,注意把握相关实验现象,题目难度中等.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:选择题
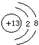 ,下列说法中不正确的是( )
,下列说法中不正确的是( )| A. | 该元素原子的原子核外有2个电子层 | |
| B. | 该元素是一种金属元素 | |
| C. | 该粒子是阳离子 | |
| D. | 该粒子具有稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
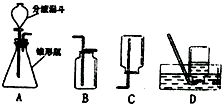 过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:
过氧化氢溶液在二氧化锰作催化剂的条件下能迅速分解,分液漏斗可以通过调节活塞控制液体的滴加速度,请根据图回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 半导体材料砷化镓 | B. | 透明陶瓷材料硒化锌 | ||
| C. | 吸氢材料镧镍合金 | D. | 超导材料K3C60 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=1.0 mol•L-1•min-1 | ||
| C. | v(H2)=1.67 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | W | R | X | Y | Z |
| 原子半径/nm | 0.037 | 0.186 | 0.074 | 0.075 | 0.077 |
| 主要化合价 | +1 | +1 | -2 | -3,+5 | +2,+4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(O2 )=0.01mol•L-1•s-1 | B. | V(NO )=0.08mol•L-1•s-1 | ||
| C. | V(H2O)=0.01mol•L-1•s-1 | D. | V(NH3)=0.002mol•L-1•s-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com