
分析 (1)由①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol;
根据盖斯定律:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=$\frac{3①-②}{2}$,进行计算求解;
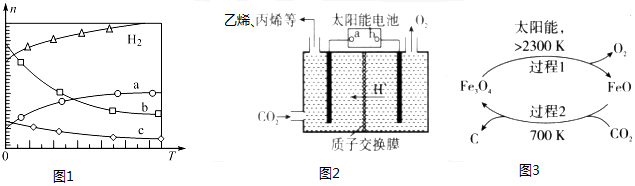
(2)由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热;可知a为CO2的变化曲线,结合计量数关系可知b为水,c为C2H4的变化曲线;
(3)太阳能电池为电源,电解强酸性的二氧化碳水溶液得到丙烯,丙烯在阴极生成;
(4)①由示意图可知,过程1中四氧化三铁在大于2300K条件下分解生成氧化亚铁和碳;
②反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,结合元素化合价以及方程式计算.
解答 解:(1)由①2H2(g)+O2(g)═2H2O(l)△H=-283.0 kJ/mol;
②2CH3OH(1)+3O2(g)═2CO2(g)+4H2O(l)△H=-726.0 kJ/mol;
根据盖斯定律:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=$\frac{3①-②}{2}$=$\frac{3×(-283.0)-(-726.0)}{2}$=-61.5 kJ/mol,
故答案为:CO2(g)+3H2(g)?CH3OH(l)+H2O(l)△H=-61.5 kJ/mol;
(2)①由曲线变化可知随着温度升高,氢气的物质的量逐渐增多,说明升高温度平衡逆向移动,则正反应放热,Q<0,
故答案为:<;
②随着温度升高,氢气的物质的量逐渐增多,因氢气为反应物,则另一条逐渐增多的曲线为CO2,由计量数关系可知b为水,c为C2H4的变化曲线,
故答案为:H2O;
(3)①太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,可知能量转化形式有光能转化为电能,电能转化为化学能,部分电能转化为热能,
故答案为:太阳能转化为电能,电能转化为化学能;
②电解时,二氧化碳在b极上生成丙烯,得到电子的一极为电源的正极,电极反应式为:3CO2+18H++18e-=C3H6+6H2O,
故答案为:3CO2+18H++18e-=C3H6+6H2O;
(4)①由示意图可知,过程1中四氧化三铁在大于2300K条件下分解生成氧化亚铁和碳,反应的化学方程式为:2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑,
故答案为:2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑;
②反应2Fe3O4$\frac{\underline{\;2300K\;}}{\;}$6FeO+O2↑中O元素化合价由-2价升高到0价,由方程式可知,2molFe3O4参加反应,生成1mol氧气,转移4mol电子,则每分解lmolFe3O4转移电子的物质的量为2mol,
故答案为:2mol.
点评 本题涉及热化学方程式书写和盖斯定律计算、氧化还原、化学平衡移动以及原电池反应等知识,考查了学生分析问题、解决问题的能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
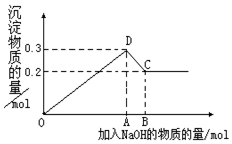 在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:
在MgCl2和AlCl3的混合溶液中,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH的物质的量(mol)和所得沉浮的物质的量(mol)的关系如图所示.则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2CO3 | C. | KAl(SO4)2•12H2O | D. | CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管量取16.00 mL KMnO4溶液 | |
| B. | 用乙醇萃取水溶液中的溴单质 | |
| C. | 用托盘天平称取5.6 g食盐 | |
| D. | 用标准盐酸滴定未知浓度的NaOH溶液消耗盐酸的体积为21.5 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶头滴管伸入量筒内滴加液体 | |
| B. | 用酒精灯的外焰给盛有液体(液体体积约占试管体积的$\frac{1}{4}$)的试管加热 | |
| C. | 称量完药品后,将药匙内剩余的药品放回试剂瓶 | |
| D. | 过滤时漏斗的末端在烧杯的中央 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1
科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇(CH3OH),并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ•mol-1、-283.0kJ•mol-1和-726.5kJ•mol-1查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com