
| A. | H2、N2、CCl4 | B. | CH4、NH3、H2O | C. | CO2、CS2、Cl2 | D. | HCl、NO、Br2 |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键.
正负电荷的重心重合,电荷分布均匀,则为非极性分子.
分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A、H2、N2都是由同种原子构成的双原子分子,全部是以非极性键形成的非极性分子,CCl4是以极性键形成的分子,故A错误;
B、CH4、NH3、H2O全部是以极性键形成的分子,故B正确;
C、Cl2是由同种原子构成的双原子分子,只含有非极性键,故C错误;
D、Br2是由同种原子构成的双原子分子,只含有非极性键,故D错误.
故选B.
点评 本题考查了共价键极性的判断,注意根据形成的共价键的原子分析,本题难度不大.


科目:高中化学 来源: 题型:多选题
| A. | C2H6 | B. | C4H8 | C. | C3H8 | D. | C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
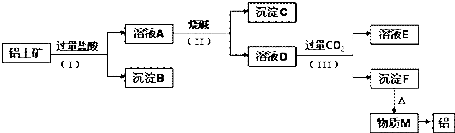
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号、物理量 | M(Fe粉)/g | V[0.05mol.L-1Na2S2O8]/mL | V[H2O]/mL | 收集数据和得出结论 | |
| 1 | 100 | 0.3 | 50 | 50 | |
| 2 | 100V(污水)/mL | 0.3 |
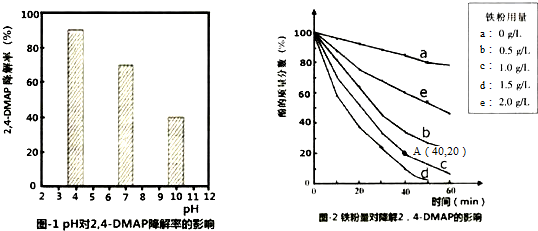
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸钠和金刚石 | B. | 晶体硅和水晶 | C. | 冰和干冰 | D. | 苯和四氯化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
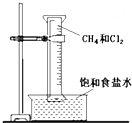 如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:
如图所示,用排饱和食盐水法先后收集20ml CH4和 80mlCl2,放在光亮的地方(注意:不要放在日光直射的地方,以免引起爆炸),等待片刻,观察发生的现象.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 当生成沉淀达到最大量时,消耗NaOH溶液的体积为150mL | |
| B. | 当金属全部溶解时收集到NO气体的体积为0.336L(标准状况下) | |
| C. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.6mol | |
| D. | 参加反应的金属的总质量一定是9.9g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com