
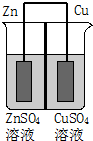
 如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )
如图为一原电池示意图,在原电池两极之间设有隔膜,离子可以自由通过.则下列说法不正确的是( )| A. | Zn2+通过隔膜从负极区向正极区移动 | |
| B. | 电子由Cu极通过导线流向Zn极 | |
| C. | 一段时间后ZnSO4溶液浓度增大CuSO4溶液浓度减小 | |
| D. | Cu2+与Zn2+物质的量之和保持不变 |
分析 该原电池中,锌易失电子作负极,铜作正极,负极上电极反应式为Zn-2e+=Zn2+,正极上电极反应式为Cu2++2e+=Cu,电池反应式为Zn+Cu2+=Zn2++Cu,放电时,电子从负极沿导线流向正极,电流从铜沿导线流向锌,原电池工作时阳离子向正极移动,以此解答该题.
解答 解:A.原电池工作时,阳离子向正极移动,则Zn2+通过隔膜从负极区向正极区移动,故A正确;
B.Zn失去电子被氧化,电子沿导线从Zn极流向Cu极,故B错误;
C.该原电池总反应为Zn+CuSO4=Cu+ZnSO4,故CuSO4浓度减小,ZnSO4浓度增大,故C正确;
D.由方程式可以看出,每消耗1molZn则生成1molCu,则Cu2+与Zn2+物质的量之和保持不变,故D正确.
故选B.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理和电极方程式的书写,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.7克-OH中含有的电子数为NA | |
| B. | 42g乙烯与丙烯的混合气体中含碳原子数为3NA | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA | |
| D. | 乙烯和乙醇的混合物共0.1mol,完全燃烧所消耗的氧气的分子数一定为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用洁净铂丝蘸取溶液进行焰色反应,火焰呈黄色,则原溶液中有Na+,无K+ | |
| B. | 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 | |
| C. | 进行钠的焰色反应实验,可用到的实验用品有:铂丝、氯化钠溶液、稀盐酸 | |
| D. | 焰色反应是某些金属单质具有的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
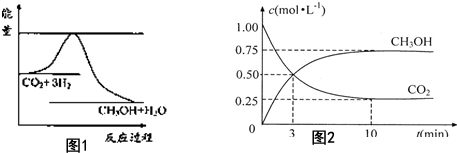 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇.一定条件下发生反应:CO2(g)+3H2O(g)?CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ•mol-1)的变化.(已知气体物质的量增加是熵变大的过程)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.
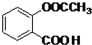 .
.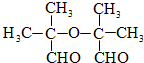 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com