
| A. | 1molH2O的质量为18g/mol | |
| B. | O2 的摩尔质量为32g | |
| C. | 2mol NaOH 溶于1 L水中配成溶液的浓度为2mol/L | |
| D. | 6.02×1023个CO分子的质量约为28g |
分析 A.1molH2O的质量为18g;
B.O2 的摩尔质量为32g/mol;
C.应是溶液的体积为1L,不是溶剂水的体积为1L;
D.根据n=$\frac{N}{{N}_{A}}$计算CO物质的量,再根据m=nM计算其质量.
解答 解:A.H2O的摩尔质量为18g/mol,1molH2O的质量为18g,故A错误;
B.1molO2 的质量为32g,O2 的摩尔质量为32g/mol,故B错误;
C.2mol NaOH 溶于水中配成1L溶液,所得溶液的浓度为2mol/L,故C错误;
D.6.02×1023个CO分子的物质的量为1mol,其质量约为1mol×28g/mol=28g,故D正确,
故选:D.
点评 本题考查物质的量有关计算、摩尔质量、物质的量浓度,注意对基本概念的理解与掌握.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | Cu2+和SO42- | B. | K+和SO42- | C. | Cu2+和Cl- | D. | Ag+和NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
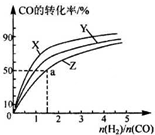 天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.
天然气、可燃冰的主要成分都是甲烷,甲烷既是一种清洁能源,又是一种重要的化工原料.| 温度(℃) | 800 | 1000 | 1200 | 1400 |
| 平衡常数(K) | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2(SO4)3 | B. | 稀硫酸 | C. | AgNO3溶液 | D. | CuSO4 溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )
如图所示的原电池装置,X、Y为两电极,电解质溶液为稀硫酸,外电路中的电子流向如图所示,对此装置的下列说法正确的是( )| A. | 外电路的电流方向为:X→外电路→Y | |
| B. | 若两电极分别为Zn和石墨棒,则X为石墨棒,Y为Zn | |
| C. | 若两电极都是金属,则它们的活动性为X>Y | |
| D. | X极上发生的是还原反应,Y极上发生的氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③⑥ | C. | ①③④ | D. | ②⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com