
��ij������Һ�����ܺ���I﹣��Cl﹣��H2SO3��NH4+���ֱ��������ʵ�飺
�ټ���ʱ�ų����������ʹƷ����Һ��ɫ��
�ڼӼ�������Ժ���ʱ�ų����������ʹʪ��ĺ�ɫʯ����ֽ������
�ۼ�����ˮ��CCl4���ú��²���Ϻ�ɫ��ȡ�ϲ���Һ�����������м���AgNO3��Һʱ�������İ�ɫ����������ϡ���ᣮ
��������������ȷ��������Һ���Ƿ���ڵ��ǣ���
A�� I﹣ B�� Cl﹣ C�� H2SO3 D�� NH4+
���㣺 ���������ӵļ��飻���������ӵļ��飮
ר�⣺ ���ʼ�������⣮
������ ���������������ʹƷ����Һ��ɫ��������ʹʪ��ĺ�ɫʯ����ֽ������������ˮ��CCl4���ú��²���Ϻ�ɫ������I﹣���ӣ��ݴ����ش����⣮
��� �⣺��1�����ȣ��ų����������ʹƷ����Һ��ɫ��֤�����к���H2SO3��
��2��ȡԭ��Һ�Ӽ������Һ�ʼ��ԣ����ȣ��ų���������ʹʪ��ĺ�ɫʯ����ֽ������֤������笠����ӣ�
��3��������ˮ��CCl4���ú��²���Ϻ�ɫ������I﹣���ӣ�ȡ�ϲ���Һ�����������м���AgNO3��Һʱ�������İ�ɫ����������ϡ���ᣬ֤�����������ӣ������ڼ�����ˮ��ǰ���£������������ӣ����Բ���ȷ����������ԭ��Һ���Ƿ���ڣ�
��ѡB��
������ ���⿼�鳣�������ӵļ��飬Ҫ���ճ��������ӵļ��鷽����������ƺ�����ʵ�飮


 ����������ϵ�д�
����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ij��Һ�п����������������е�һ�ֻ��֣�SO42����CO32����Cl����OH����
��1������Һ���д���H+����ʱ���������������ڣ�������Ӧ�����ӷ���ʽ������
����Һ���д���Ba2+����ʱ������������ ���ڣ�������Ӧ�����ӷ���ʽ������
��3������ij��Һ���Ƿ����SO42�����Լ�Ϊ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���Ƶ�˼ά�����ڻ�ѧѧϰ���о�����ʱ�����������ۣ�������ƵĽ�������Ҫ����ʵ���ļ��飬����ȷ������ȷ������м������ƽ����У�������ǣ���
������ˮ��Ӧ����NaOH��H2�����н�����ˮ��Ӧ�����ɼ��H2
����¶���ڿ�����һ��ʱ���ͻ����⣻���ʸ����õ��������ȶ������ڿ�����
�ۻ�����NaCl����ɫΪ��ɫ��Na2CO3����ɫҲΪ��ɫ
���ܶ�Ϊ1.1g•cm﹣3���ܶ�Ϊ1.2g•cm﹣3��NaCl��Һ�������ϣ�����NaCl��Һ���ܶȽ���1.1g•cm﹣3��1.2g•cm﹣3֮�䣻NaK�Ͻ���۵�Ӧ����Na��K�۵�֮�䣮
A�� �٢� B�� �٢� C�� �٢ڢۢ� D�� �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijһ��Ӧ��ϵ���з�Ӧ��������ﹲ�������ʣ�O2��H2CrO4��Cr��OH��3��H2O��H2O2��
��֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2﹣��O2��
��1���÷�Ӧ�еĻ�ԭ���� ��
��2���÷�Ӧ�У�������ԭ��Ӧ�Ĺ����� �� ��
��3��д���÷�Ӧ�Ļ�ѧ����ʽ�����õ����ŷ��������ת�Ƶķ������Ŀ ��
��4���練Ӧת����0.3mol���ӣ�������������ڱ�״�������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���л�ѧ�����ʾ����ȷ���ǣ���
A�� Na+�Ľṹʾ��ͼ  B�� ���Ȼ�̼�ĵ���ʽ
B�� ���Ȼ�̼�ĵ���ʽ 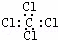
C�� ������̼�ĽṹʽΪO=C=O D�� ��ϩ��ʵ��ʽΪ CH2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�л��������࣬�����������й���ģ������л����������ȷ���ǣ���
A�� 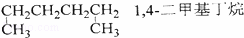 B��
B�� 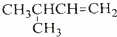 2﹣��﹣3﹣��ϩ
2﹣��﹣3﹣��ϩ
C�� 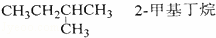 D�� CH2Cl﹣CH2Cl ��������
D�� CH2Cl﹣CH2Cl ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
25��ʱ����ͼ�ձ��и�ʢ��25mL����Һ��
��1������ҺpH=1��
��2����������Һȫ���������У����õĻ����Һ��pH�����������������=���� ����Һ��pH��
��3����������Һȫ��������У����õĻ����ҺpH��7��������Һ������Ũ�ȴ�С˳���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
NaCl��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʣ�����˵����ȷ���ǣ���
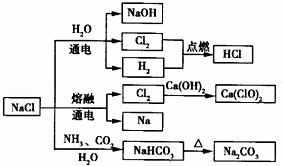
A�� 25�棬NaHCO3��ˮ�е��ܽ�ȱ�Na2CO3�Ĵ�
B�� ʯ������Cl2�ķ�Ӧ�У�Cl2���������������ǻ�ԭ��
C�� �����¸����Cl2���ø�ƿ���棬����Cl2��������Ӧ
D�� ��ͼ��ʾת����Ӧ����������ԭ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����Ƕ�ij��Һ�������Ӽ���ķ����ͽ��ۣ�������ȷ���ǣ���
A�� �ȼ���BaCl2��Һ���ټ���HNO3��Һ�������˰�ɫ����������Һ��һ�����д�����SO42﹣
B�� ����������CaCl2��Һ�������˰�ɫ����������Һ��һ�����д�����CO32﹣
C�� �������ᣬ�ܲ���ʹ����ʯ��ˮ����ǵ����壬����Һ��һ������CO32﹣
D�� �ȼ����������Ὣ��Һ�ữ���ټ���AgNO3��Һ�������˰�ɫ����������Һ��һ�����д�����Cl﹣
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com