
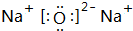 .
.分析 A、B、W、D、E为短周期元素,且原子序数依次增大,E为地壳中含量最高的金属元素,则E为Al;D、W能形成两种离子化合物D2W和D2W2,则D为Na、W为O元素;元素质子数之和为39,则A、B质子数之和为39-8-11-13=7,B、W同周期,A、D同主族且晶体类型不同,则A为H元素、B为C元素,据此解答.
解答 解:A、B、W、D、E为短周期元素,且原子序数依次增大,E为地壳中含量最高的金属元素,则E为Al;D、W能形成两种离子化合物D2W和D2W2,则D为Na、W为O元素;元素质子数之和为39,则A、B质子数之和为39-8-11-13=7,B、W同周期,A、D同主族且晶体类型不同,则A为H元素、B为C元素.
(1)D元为Na,在周期表中的位置为:第三周期ⅠA族,Na2O的电子式为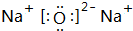 ,
,
故答案为:第三周期ⅠA族;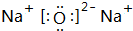 ;
;
(2)E的最高价氧化物为Al2O3,D的最高价氧化物的水化物为NaOH,二者反应的离子方程式为Al2O3+2OH-=2AlO2-+H2O,故答案为:Al2O3+2OH-=2AlO2-+H2O;
(3)由H、C、O三种元素组成的18电子微粒的结构简式为CH3OH,故答案为:CH3OH;
(4)H2O2具有强氧化性,会氧化I-、Fe2+,做H2O2分解的催化剂,在反应过程中先被还原,后被氧化,该离子为高价态离子,会表现氧化性,可能为Fe3+、Cu2+,
故答案为:②③;
(5)Na的单质在一定条件下,能与氢气化合生成一种氢化物NaH,能与水反应放氢气,发生反应:NaH+H2O=NaOH+H2↑,则:
NaH+H2O=NaOH+H2↑
1mol 1mol 1mol
2NaOH+2Al+2H2O=2NaAlO2+3H2↑
1mol 1mol 1.5mol
n(H2)=1mol+1.5mol=2.5mol,
V(H2)=2.5mol×22.4L/mol=56L,
故答案为:56.
点评 本题考查元素的推断和元素化合物知识,难度中等,本题侧重于常见化合物的存在为突破口,注重于元素化合物的考查,做题时注意把握题给信息.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
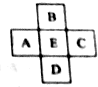 原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )
原子序数为x的元素E在周期表中位于A、B、C、D四种元素中间(如图所示),则A、B、C、D四种元素的原子序数之和不可能是(镧系、锕系、O族元素除外)( )| A. | 4x | B. | 4x+6 | C. | 4x+10 | D. | 4x+14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.
,它的化学键属于共价键;含有离子键和共价键的化合物的化学式为Na2O2.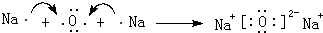 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl的溶解度增大 | B. | AgCl的溶解度增大,Ksp不变 | ||
| C. | C(Ag+)增大 | D. | AgCl的溶解度、Ksp均不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 运用元素周期律研究元素及其化合物的性质具有重要意义.
运用元素周期律研究元素及其化合物的性质具有重要意义.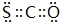 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液(HCl酸化的BaCl2溶液) | B. | 氯水(AgNO3溶液) | ||
| C. | 漂白粉(稀硝酸) | D. | NaOH溶液(Ba(OH)2溶液) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
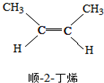 ?
? △H=-4.2kJ/mol.
△H=-4.2kJ/mol.| A. | 顺-2-丁烯比反-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热比反-2-丁烯大 | |
| C. | 降温有利于平衡向生成顺-2-丁烯反应方向移动 | |
| D. | 反-2-丁烯和顺-2-丁烯具有相同的熔沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com