
| A、①⑦ | B、①②⑦ |
| C、①④⑦ | D、①③⑤⑦ |


科目:高中化学 来源: 题型:
| A、人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2 |
| B、中国的三峡大坝使用了大量水泥,水泥是硅酸盐材料 |
| C、化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,码瑙的主要成分是Al2O3 |
| D、用于现代通讯的光导纤维的主要成分是高纯度的硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| A、Q1<Q2 |
| B、反应物总能量均高于生成物总能量 |
| C、由1mol C(s)反应生成1mol CO气体时放出Q1 kJ热量 |
| D、1mol CO2气体具有的能量小于1mol干冰具有的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纤维素、淀粉和蛋白质都是高分子化合物 |
| B、食盐、醋酸和蔗糖都是电解质 |
| C、甲烷和乙烯均可使酸性KMnO4溶液褪色 |
| D、乙酸乙酯和植物油均可水解生成乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L氯气与足量的氢氧化钠溶液反应转移的电子数为NA |
| B、22.4L氨气中原子总数为4NA |
| C、标准状况下,22.4L SO3的分子数为NA |
| D、0.1mol/L CaCl2溶液中含有0.2NA个Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
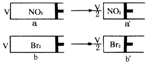 两个体积相同带活塞的容器,分别盛装一定量的NO2和Br2(g),都为一样的红棕色,迅速将两容器同时压缩到原来的一半(如图)假设气体不液化,则下列说法正确的是( )
两个体积相同带活塞的容器,分别盛装一定量的NO2和Br2(g),都为一样的红棕色,迅速将两容器同时压缩到原来的一半(如图)假设气体不液化,则下列说法正确的是( )| A、a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅 |
| B、a′,b′的颜色一样深 |
| C、a′的压强比a的压强2倍要小,b′的压强为b的压强的2倍 |
| D、a′中的c(NO2)一定比b′中的c(Br2 )小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
| A、当SO3的生成速率与SO2的消耗速率相等时反应达到平衡 |
| B、降低温度,正反应速率减小程度比逆反应速率减小程度大 |
| C、将平衡混合气体通入过量BaCl2溶液中,会得到两种白色沉淀 |
| D、该反应过程中转移了2mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同时改变两个变量来研究反应速率的变化,能更快得出有关规律 |
| B、对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 |
| C、Na2O2、H2O2所含化学键完全相同,都能作供氧剂 |
| D、根据氧化物的组成元素将氧化物分成酸性氧化物碱性氧化物和两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
| c(H2SO3) | ||
c(HS
|
c(S
| ||
c(HS
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com