
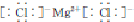 ,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能.
,工业上用电解无水氯化镁而不是氧化镁获得镁的原因是消耗大量的电能. (g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$
(g)+3H2(g) $?_{FeSO_{4}/Al_{2}O_{3}}^{高温}$ (g)
(g) 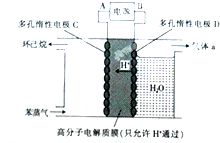
分析 (1)镁位于周期表的第三周期第ⅡA族;氯化镁为离子化合物;根据氧化镁具有较高的熔点,电解氧化镁获得镁要消耗大量的电能;
(2)Mg(AlH4)2中Mg是+2价,Al是+3价,则H为-1价;根据题意,Mg(AlH4)2═MgH2+2Al+3H2↑,氧化产物与还原产物的物质的量之比为3:2;
(3)①根据图知,苯中的碳得电子生成环己烷,则C作阴极,阴极上苯得电子和氢离子生成环己烷,D作阳极,所以A是负极、B是正极;
②阳极上生成氧气,同时生成氢离子,阴极上苯得电子和氢离子反应生成环己烷;
(4)①镁、铝是亲氧元素,易被氧气氧化;
②释放出的H2 包括Mg17Al12吸收的氢,还包括镁、铝和盐酸反应生成的氢气.
解答 解:(1)镁位于周期表的第三周期第ⅡA族;氯化镁为离子化合物,其电子式为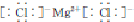 ;因为氧化镁具有较高的熔点,电解氧化镁获得镁要消耗大量的电能,所以用电解无水氯化镁而不是氧化镁获得镁,
;因为氧化镁具有较高的熔点,电解氧化镁获得镁要消耗大量的电能,所以用电解无水氯化镁而不是氧化镁获得镁,
故答案为:第三周期第ⅡA族;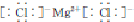 ;消耗大量的电能;
;消耗大量的电能;
(2)Mg(AlH4)2中Mg是+2价,Al是+3价,则H为-1价;根据题意,Mg(AlH4)2═MgH2+2Al+3H2↑,氧化产物与还原产物的物质的量之比为3:2;
故答案为:-1;3:2;
(3)①根据图知,苯中的碳得电子生成环己烷,则C作阴极,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,D作阳极,所以A是负极、B是正极,阳极上氢氧根离子放电生成氧气,故答案为:负极;氧气;
②根据图知,苯中的碳得电子生成环己烷,则C作阴极,阴极上苯得电子和氢离子生成环己烷,电极反应式为C6H6+6H++6e-=C6H12,故答案为:C6H6+6H++6e-=C6H12;
(4)①镁、铝都是活泼的金属单质,容易被空气中的氧气氧化,通入氩气作保护气,以防止二者被氧化,故答案为:防止Mg、Al被空气氧化;
②1molMg17Al12完全吸氢17mol,在盐酸中会全部释放出来,镁铝合金中的镁和铝都能与盐酸反应生成H2,生成氢气的物质的量分别为17mol、18mol,则生成氢气一共(17+17+12×$\frac{3}{2}$)mol=52mol,故答案为:52mol.
点评 本题考查较综合,涉及常见金属元素及其化合物主要性质、氧化还原反应的计算、化学平衡计算、电化学原理等,把握化学反应原理为解答的关键,侧重分析、应用能力的考查,题目难度中等.


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 往反应后的溶液中加入AgNO3溶液检验是否有Br-生成 | |
| B. | 实验中观察不到有气体生成 | |
| C. | 生成的气体可直接通入到溴水中检验是否有乙烯生成 | |
| D. | 生成的气体可直接通入到酸性高锰酸钾溶液中检验是否有乙烯生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na20和SiO2熔化 | B. | 冰和金刚石熔化 | ||
| C. | 氯化钠和蔗糖熔化 | D. | 碘和干冰升华 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用盐酸、BaCl2溶液鉴别Cl-、SO42-和CO32- | |
| C. | 用溴水鉴别CH4和C2H4 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁炔 | B. | 1,3,4-三甲苯 | C. | 3-甲基-2-丁烯 | D. | 2-乙基-2-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
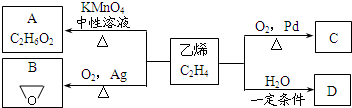 乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.
乙烯有如下转化关系.乙烯在不同的条件下可被氧化成不同产物,如A、B、C.已知:取0.01mol A与足量的钠完全反应后,生成224mL(标准状况)气体.C是B的同分异构体,C与新制的氢氧化铜浊液一起加热,会产生红色沉淀.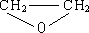 +H2O$\stackrel{一定条件}{→}$
+H2O$\stackrel{一定条件}{→}$ .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
 .
.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com