
下列有关气体的叙述中,错误的是()
A. 不同的气体,若体积不同,则它们所含的分子数肯定不同
B. 在标准状况下,气体的摩尔体积约为22.4L•mol﹣1
C. 当分子数目相同时,气体体积的大小主要取决于气体分子之间的距离
D. 气态物质没有固定的形状,且容易被压缩
考点: 物质的量的相关计算;阿伏加德罗定律及推论.
专题: 阿伏加德罗常数和阿伏加德罗定律.
分析: A.气体体积不同,但气体的物质的量可能相同;
B.标准状况下,气体的摩尔体积约为22.4L•mol﹣1;
C.气体分子间距远远大于分子大小,分子大小可以忽略;
D.气体分子间距远远大于分子大小,容易被压缩,没有固定的形状.
解答: 解:A.不同气体,体积不同,但气体的物质的量可能相同,可能含有相同的分子数,故A错误;
B.标准状况下,气体的摩尔体积约为22.4L•mol﹣1,故B正确;
C.气体分子间距远远大于分子大小,分子大小可以忽略,分子数目一定,气体体积取决于分子之间的距离,故C正确;
D.气体没有固定的形状,气体分子间距远远大于分子本身的大小,容易被压缩,故D正确.
故选A.
点评: 本题考查对气体摩尔体积的理解,难度不大,注意理解影响物质体积的因素.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
可逆反应A(g)+B⇌C(g)+D,达到平衡时,下列说法不正确的是( )
|
| A. | 若B是气体,增大A的浓度会使B转化率增大 |
|
| B. | 若增大A的浓度,平衡体系颜色加深,则D是有颜色的气体 |
|
| C. | 升高温度,C百分含量减少,说明正反应是放热反应 |
|
| D. | 增大压强,平衡不移动,说明B、D有可能是非气态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有①Na2CO3溶液;②CH3COONa溶液;③NaOH溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
|
| A. | 三种溶液pH的大小顺序是③>②>① |
|
| B. | 若将三种溶液稀释相同倍数,pH变化最大的是② |
|
| C. | 若分别加入25mL 0.1mol/L盐酸后,pH最大的是① |
|
| D. | 若三种溶液的pH均为9,则物质的量浓度的大小顺序是③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是 ( )。
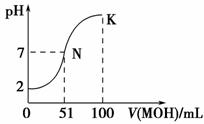
A.HA为一元强酸
B.MOH为一元弱碱
C.N点水的电离程度小于K点水的电离程度
D.若K点对应溶液的pH=10,则有c(MOH)+c(OH-)-c(H+)=0.005 mol
·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
1998年诺贝尔化学奖授予科恩(美)和波普尔(英)以表彰他们在理论化学领域作出的重大贡献.他们的工作使实验和理论能够共同协力探讨分子体系的性质,引起整个化学领域正在经历一场革命的变化.下列说法正确的是()
A. 化学不再是纯实验科学
B. 化学不再需要实验
C. 化学不做实验,就什么都不知道
D. 未来化学的方向还是经验化
查看答案和解析>>
科目:高中化学 来源: 题型:
对于某些常见离子的检验及结论一定正确的是()
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32﹣
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸沉淀不消失,一定有SO42﹣
C. 加入氯化钠溶液有白色沉淀产生,再加稀硝酸沉淀不消失,一定有Ag+
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+
查看答案和解析>>
科目:高中化学 来源: 题型:
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl﹣、Mg2+、Ba2+、CO32﹣、SO42﹣,现取三份100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生;
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol;
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是()
A. 无法确定K+ 存在
B. 100mL溶液中含0.01mol CO32﹣
C. Cl﹣ 可能存在
D. Ba2+ 一定不存在,Mg2+ 可能存在
查看答案和解析>>
科目:高中化学 来源: 题型:
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是
a.Fe2O3 b.MgCl2 c.Cu2S d.Ag2O
(2)钢铁是21世纪用途最广的结构材料和功能材料。工业上在炼铁高炉中用CO热还原Fe2O3冶炼铁。写出该反应的化学方程式并用单线桥表示电子转移的方向和数目。
|
(3)辉铜矿(Cu2S)可发生反应2Cu2S+3O2======2Cu2O+2SO2,该反应的氧化产物是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。煅烧2.0t含80%Cu2S的辉铜矿石(杂质不参加反应)时,若SO2 的利用率为94%,可生产质量分数为98%的硫酸的质量为 t。(4分)
查看答案和解析>>
科目:高中化学 来源: 题型:
化学上常用燃烧法确定有机物的组成。如图CA32所示装置是用燃烧法确定烃或烃的含氧衍生物分子式的常用装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
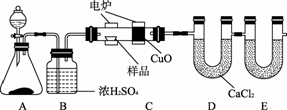
图CA32
回答下列问题:
(1)A装置中分液漏斗内盛放的物质是______,写出有关反应的化学方程式:_________
________________________________________________________________________。
(2)C装置(燃烧管)中CuO的作用是________________________________。
(3)写出E装置中所盛放物质的名称:__________________,它的作用是____________。
(4)若将B装置去掉会对实验结果造成什么影响?
________________________________________________________________________。
(5)若准确称取1.20 g样品(烃或烃的含氧衍生物),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的实验式为__________。
(6)要确定该有机物的分子式,还要______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com