
| A. | 1.5mol单质Fe粉在足量氧气中完全燃烧,失去4NA个电子 | |
| B. | 在25g质量分数为60%的乙酸水溶液中,含有氢原子数为NA | |
| C. | 7.8 gNa2S和Na2O2 的混合物中,含有的阴离子数等于0.15NA | |
| D. | 在5×107Pa、500°C和铁触媒作用下,1molN2和3molH2可生成氨气分子数为2NA |
分析 A.铁在氧气中燃烧生成四氧化三铁;
B.乙酸溶液中乙酸、和水都含有氢原子;
C.过氧化钠中的阴离子为过氧根离子,硫化钠和过氧化钠的摩尔质量都是78g/mol;
D.可逆反应不能进行到底;
解答 解:A.铁在氧气中燃烧生成四氧化三铁,铁在氧气中燃烧生成的是四氧化三铁,铁元素的平均化合价为+$\frac{8}{3}$价,则:1.5mol单质Fe粉在足量氧气中完全燃烧,失去电子$\frac{8}{3}$×$\frac{3}{2}$=4mol,失去4NA个电子,故A正确;
B.乙酸溶液中乙酸、和水都含有氢原子,所以在25g质量分数为60%的乙酸水溶液中,含有氢原子数远远大于NA,故B错误;
C.7.8g Na2S和Na2O2的物质的量为:$\frac{7.8g}{78g/mol}$=0.1mol,过氧化钠中阳离子为过氧根离子,则0.1mol混合物中含有0.1mol阴离子,含有的阴离子数等于0.1NA,故C错误;
D.氮气与氢气反应生成氨气为可逆反应,不能进行到底,所以1molN2和3molH2可生成氨气分子数小于2NA,故D错误;
故选:A.
点评 本题考查阿伏加德罗常数的有关计算和判断,明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意过氧化钠中阴离子为过氧根离子,题目难度中等.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | N2和H2在一定条件下反应生成NH3 | |
| B. | NH3经过一系列反应之后生成硝酸盐 | |
| C. | NO与O2反应生成NO2 | |
| D. | 氯化铵受热分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
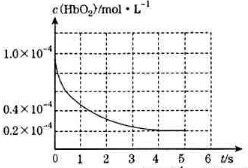 人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )
人体吸入CO后在肺部发生反应CO+HbO2?O2+HbCO导致人体缺氧.向某血样中通入CO与O2的混合气[c(CO)=1.0×10-4mol/L,c(O2)=9.9×10-4mol/L]氧合血红蛋白HbO2浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 反应开始至4s内用HbO2表示的平均反应速率为2×10-4mol/(L•s) | |
| B. | 反应达平衡之前,O2与HbO2的反应速率逐渐减小 | |
| C. | 将CO中毒病人放入高压氧舱治疗是利用了化学平衡移动原理 | |
| D. | 该温度下反应CO+HbO2?O2+HbCO的平衡常数为107 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CCl4可用于鉴别溴水和碘水 | |
| B. | 甲苯(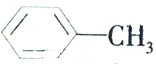 )中所有原子都在同一平面内 )中所有原子都在同一平面内 | |
| C. | 1mol甲苯含有6NA个C-H键 | |
| D. | 苯与甲苯互为同系物,均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有10种元素的性质、数据如下表所列,它们均为短周期元素.
现有10种元素的性质、数据如下表所列,它们均为短周期元素.| A | B | C | D | E | F | G | H | I | J | |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
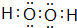 ,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式:
,构成该物质的化学键类型有极性键和非极性键;画出A与B形成化合物的形成过程表示式: _.
_.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
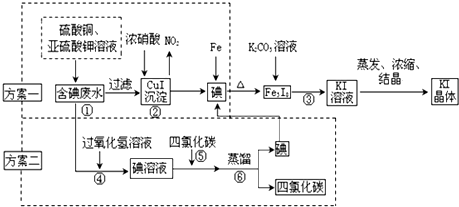
| 步骤 | 操作 | 现象 |
| 一 | 取黑色物质于烧杯中,加适量水进行洗涤、干燥 | 黑色物质未溶解 |
| 二 | 取适量固体于稀硫酸中进行充分溶解 | 无气体生成 |
| 三 | 移取少量步骤二溶液于试管A中,并滴加硫氰化钾溶液 | 溶液为血红色 |
| 四 | 移取少量步骤二溶液于试管B中,滴加酸性KMnO4溶液 | 酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com