
电解100 mL含c(H+)=0.30 mol·L-1下列溶液,当电路中通过0.04 mol
电子时,理论上析出金属质量最大的是( )
A.0.10 mol·L-1AgNO3溶液
B.0.10 mol·L-1ZnSO4溶液
C.0.20 mol·L-1CuCl2溶液
D.0.20 mol·L-1Pb(NO3)2溶液
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
A1 mol葡萄糖能水解生成2 mol CH3CH2OH和2 mol CO2
B.在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀
C.油脂不是高分子化合物,1 mol油脂完全水解生成1 mol 甘油和3 mol高级脂肪酸
D.欲检验蔗糖水解产物是否具有还原性,可向水解后的溶液中直接加入新制的Cu(OH)2悬浊液并加热
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素X、Y、Z所在的周期数依次增大,它们的原子序数之和为20,且Y2-与Z+核外电子层的结构相同。下列化合物中同时存在极性和非极性共价键的是 ( )
A.Z2Y B.X2Y2 C.Z2Y2 D.ZYX
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素,其中X、Y、Z是原子序数依次增大的同周期元素,且它们的最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的一半。下列说法正确的是( )
A.Y、Z、W能形成含有相同电子数的简单离子,且W形成的简单离子的半径最大
B.XZ2、W2Z2均为直线形的共价化合物
C.Z与M形成的3原子化合物比Y与M形成的4原子化合物稳定
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )。
A.用惰性电极电解饱和食盐水时,阳极的电极反应式为2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,阳极反应式为Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式:Fe-2e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
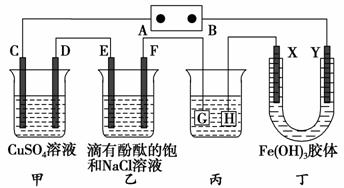
请回答:
(1)B极是电源的________,一段时间后,甲中溶液颜色________,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明____________________,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为______________。
(3)现用丙装置给铜件镀银,则H应该是________(填“镀层金属”或“镀件”),电镀液是________溶液。当乙中溶液的pH是13时(此时乙溶液体积为500 mL),丙中镀件上析出银的质量为________,甲中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是_______________________________________________________________
_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在等温等容条件下,可逆反应:2A(g)+B(g)3C(g)+D(g) ΔH=-Q1 kJ·mol-1(Q1>0),起始物质的量如下表所示:
| 序号 | A | B | C | D |
| ① | 2 mol | 1 mol | 0 | 0 |
| ② | 4 mol | 2 mol | 0 | 0 |
| ③ | 1 mol | 0.5 mol | 1.5 mol | 0.5 mol |
| ④ | 0 | 1 mol | 3 mol | 1 mol |
| ⑤ | 0 | 0 | 3 mol | 1 mol |
(1)上述反应达到平衡时,互为等效平衡的是哪几组?达到平衡后,哪些量相同?
(2)达到平衡后,①放出的热量为Q2 kJ,⑤吸收的热量为Q3 kJ,则Q1、Q2、Q3的定量关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应C(s)+H2O(g)CO(g)+H2(g)在一定密闭容器中进行,下列说法或结论中,能够成立的是( )
A.反应达平衡状态时:v(CO)正=v(H2O)逆
B.其他条件不变仅将容器的体积缩小一半,反应速率减小
C.保持体积不变,充入少量He使体系压强的增大,反应速率一定增大
D.其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
过去电子工业常用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为:
2FeCl3+Cu===2FeCl2+CuCl2。
(1)检验腐蚀后的溶液中是否含有Fe3+应选用的试剂是____________。
(2)采用下列实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液,请在各空格内填上适当的分子式或化学式以使实验达到预期目的。
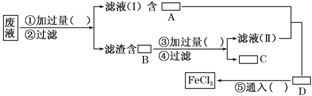
(3)写出有关化学反应的离子方程式_______________________________________,
__________________________________________________,
__________________________________________________,
__________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com