
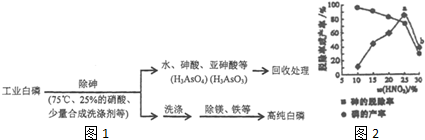
分析 (1)①磷酸属于弱电解质,第一步电离为主;
②根据化合价代数和为0计算;
(2)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,结合电荷守恒、原子守恒配平;
(3)①白磷不溶于水,熔化不能改变其毒性,提高温度可以加快反应速率,但温度过高,硝酸会分解;
②氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少;
③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷;
(4)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)与AgCl(s)?Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq),故该反应平衡时为前两者平衡常数之积;
计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,结合平衡常数计算解答.
解答 解:(1)①磷酸属于弱电解质,第一步电离为主,磷酸主要的电离方程式:H3PO4?H2PO4-+H+,
故答案为:H3PO4?H2PO4-+H+;
②根据化合价代数和为0,则(n+2)+5n-2x=0,故x=3n+1,
(2)P元素化合价由+1价升高为+5价,共升高4价,而Ag元素由+1价降低为0甲,共降低1价,化合价升降最小公倍数为4,故H2PO2-、HPO43-的系数为1,Ag+、Ag的系数为4,碱性条件下进行反应,结合电荷守恒可知反应物中缺项为OH-,由元素守恒可知生成物中缺项为H2O,平衡后方程式为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O,
故答案为:1H2PO2-+4Ag++6OH-=1PO43-+4Ag+4H2O;
(3)①a.白磷不溶于水,故a错误;
b.熔化不能改变其毒性,故b错误;
c.温度过高,硝酸会分解,需要控制合适的温度,故c正确;
d.提高温度可以加快反应速率,故d正确.
故选:cd,
故答案为:cd;
②氧化相同质量的砷,转化为亚砷酸的量越多,转移电子数目越小,消耗硝酸越少,
故答案为:少;
③硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低,
故答案为:硝酸浓度大,氧化性强,有较多的硝酸用于氧化白磷,脱砷率低;
(4)Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)的平衡常数的表达式K=$\frac{c([Ag(NY{H}_{3})_{2}]^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$,
Ag+(aq)+2NH3(aq)?Ag(NH3)2+(aq)与AgCl(s)?Ag+(aq)+Cl-(aq)相加可以得到:AgCl(s)+2NH3(aq)?Ag(NH3)2+(aq)+Cl-(aq),平衡常数表达式K=$\frac{c([Ag(N{H}_{3})_{2}]^{+})c(C{l}^{-})}{{c}^{2}(N{H}_{3})}$=$\frac{c([Ag(NY{H}_{3})_{2}]^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$×c(Ag+)×c(Cl-)=1.10×107×1.45×10-10=1.6×10-3,
计算溶解xmolAgCl,则Ag(NH3)2+为xmol/L,Cl-为xmol/L,溶液中NH3(aq)为(1-2x)mol/L,故$\frac{{x}^{2}}{(1-2x)^{2}}$
=1.6×10-3,解得x=0.04,
故答案为:$\frac{c([Ag(NY{H}_{3})_{2}]^{+})}{c(A{g}^{+}){c}^{2}(N{H}_{3})}$;1.6×10-3;0.04.
点评 本题考查物质制备工艺流程、氧化还原反应配平、平衡常数有关计算、电离方程式书写等,属于拼合型题目,侧重考查学生分析计算能力、知识迁移运用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 100 mL 2 mol/L的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 | |
| B. | 用铁片和稀硫酸反应制取氢气时,改用铁片和浓硫酸可以加快产生氢气的速率 | |
| C. | 汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,加入催化剂,不影响CO的转化率 | |
| D. | 二氧化硫的催化氧化是一个放热反应,升高温度,平衡逆向移动,正反应速率减慢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
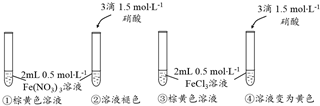
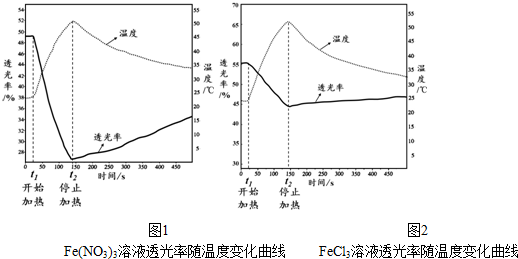
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
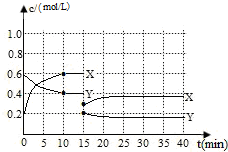 已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化
已知NO2和N2O4可以相互转化:2NO2(g)?N2O4(g)△H<0.现将一定量NO2和N2O4的混合气体通入体积为1L的恒温密闭容器中发生上述反应,反应物浓度随时间变化关系如下图所示.X与Y两条曲线中,Y表示N2O4浓度随时间的变化查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 物质的量(mol) | 0 | 10 | 20 | 30 | 40 | 50 |
| B | 2.00 | 1.36 | 1.00 | 1.00 | 1.20 | 1.20 |
| D | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
| E | 0 | 0.32 | 0.50 | 0.50 | 0.60 | 0.60 |
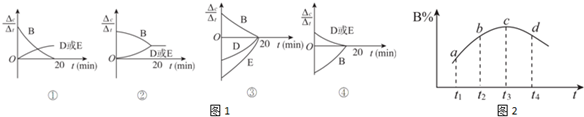
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
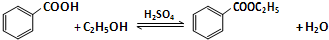
| 物质 | 颜色状态 | 密度/g/cm3 | 熔点/℃ | 沸点/℃ |
| 苯甲酸 | 白色固体 | 1.2659 | 122 | 249 |
| 苯甲酸乙酯 | 无色液体 | 1.05 | -34.6 | 212.6 |
| 乙酸 | 无色液体 | 1.0492 | 16.6 | 117.9 |
| 乙醇 | 无色液体 | 0.789 | -117.3 | 78.5 |
| 乙酸乙酯 | 无色液体 | 0.894-0.898 | -83.6 | 77.1 |
| 乙醚 | 无色液体 | 0.713 | -116.3 | 34.6 |
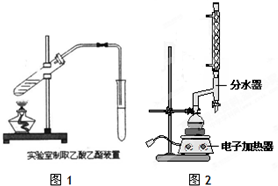
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

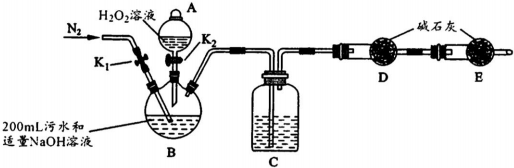
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热. |
| 步骤2 | 冷却后,用注射器穿过B装置的胶塞注入稀H2S04溶液. |
| 步骤3 | 打开K1,通入N2. |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在一定条件下,能发生取代、氧化、水解、酯化和加聚反应 | |
| B. | 该物质分子中最多可以有9个碳原子在同一平面上 | |
| C. | 1 mol该物质最多可与5mol H2发生加成反应 | |
| D. | 1 mol该物质完全氧化最多可消耗13 mol氧气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com