
【题目】下列指定反应的离子方程式正确的是( )
A.实验室用浓盐酸和MnO2混合加热制Cl2:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
B.将Cl2溶于水制备次氯酸:Cl2+H2O=2H++Cl﹣+ClO﹣
C.用过量的NaOH溶液吸收SO2:OH﹣+SO2=HSO3﹣
D.向AlCl3溶液中加入氨水:Al3++3OH﹣=Al(OH)3↓
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】I. 今有12种物质:①A1 ②稀硝酸 ③H2SO4 ④液氨 ⑤CO2 ⑥空气 ⑦NaCl CaCO3 NaHCO3 酒精![]() Al2O3
Al2O3 ![]() 石墨。以上物质中属于电解质但熔融状态下并不导电的是____________(填序号,下同),属于非电解质的是___________。
石墨。以上物质中属于电解质但熔融状态下并不导电的是____________(填序号,下同),属于非电解质的是___________。
II.按要求填写化学用语:
(1)Na2SO4的电离方程式:_______________________;
(2)Ba(OH)2与CuSO4两稀溶液混合的离子方程式:______________________;
(3)写一个能用Fe3++30H-═Fe(OH)3表示的化学方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值,下列说法不正确的是
A.16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数小于0.1 NA
B.22.4 L(标准状况)氩气含有的质子数为18NA
C.常温常压下,124 g P4中所含P—P键数目为6NA
D.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数小于0.2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带和海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() ―→
―→![]()
某化学兴趣小组将上述流程②、③设计成如下图所示操作。

已知过程②发生反应的化学方程式为Cl2+2KI===2KCl+I2
回答下列问题:
(1)写出提取过程①、③中实验操作的名称:①____________,③____________。
(2)在灼烧过程中,使用到的实验仪器有酒精灯、____________、____________(除泥三角外)。
(3)F中下层液体的颜色为________色,上层液体中溶质的主要成分为____________。
(4)从F中得到固态碘还需进行的操作是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是
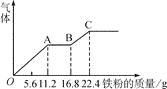
A. 图中,AB段的反应为Fe+2Fe3+=3Fe2+,溶液中溶质最终为FeSO4
B. 原溶液中H2SO4浓度为2.5 mol·L-1
C. 原混合溶液中NO3-的物质的量为0.2 mol
D. 图中,OA段产生的气体是NO,BC段产生的气体是氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一学生设计入图所示装置进行NaHCO3的分解,并证实产物中有CO2产生。
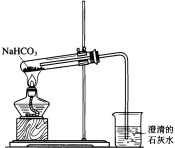
(1)试管中发生的化学反应方程式是____________________________。
(2)指出该学生设计的装置图的错误之处,并改正(文字说明即可)(至少2处)____________。
(3)烧杯中发生反应的离子方程式是_______________________________。
(4)如果将16.8gNaHCO3加热一段时间,然后将剩余固体溶于水,并加入足量的CaCl2溶液,最终得到白色沉淀5.0g,则NaHCO3分解百分率为______________,加CaCl2后反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在甲、乙、丙、丁四个恒容密闭容器中投入SO2(g)和O2(g),进行反应,2SO2+O22SO3,其起始物质的量及SO2的平衡转化率如下表所示.下列判断中正确的是( )
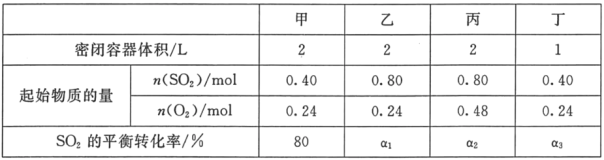
A.该温度下,该反应的平衡常数K为400
B.SO2的平衡转化率:a1>a2=a3
C.达到平衡时,容器丁中的正反应速率比容器丙中的大
D.达到平衡时,容器丙中c( SO3)大于容器甲中c( SO3)的两倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:

(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应;
②碱性水解后酸化,含苯环的产物分子中不同化学环境的氢原子数目比为1∶1。
(5)已知: (R表示烃基,R'和R"表示烃基或氢),写出以
(R表示烃基,R'和R"表示烃基或氢),写出以 和CH3CH2CH2OH为原料制备
和CH3CH2CH2OH为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com