
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 2:5 |
分析 4.32g水的物质的量为:$\frac{4.32g}{18g/mol}$=0.24mol,即0.1mol混合烃完全燃烧生成0.14molCO2和0.24molH2O,根据元素守恒,则混合烃的平均分子式为C1.4H4.8,而碳原子数小于1.6的只有甲烷,则混合气体中一定含有CH4,根据氢原子平均数目可知另一种烃分子中含有H原子数越大大于4,则一定含有C2H6,设出甲烷和乙烷的物质的量,然后根据平均分子式列式计算即可.
解答 解:4.32g水的物质的量为:$\frac{4.32g}{18g/mol}$=0.24mol,即0.1mol混合烃完全燃烧生成0.14molCO2和0.24molH2O,根据元素守恒,则混合烃的平均分子式为C1.4H4.8,而碳原子数小于1.6的只有甲烷,则混合气体中一定含有CH4,根据氢原子平均数目可知另一种烃分子中含有H原子数越大大于4,则一定含有C2H6,
设CH4、C2H6的物质的量分别为x、y,
根据平均C原子数为1.4可知:$\frac{x+2y}{x+y}$=1.4,整理可得x:y=3:2,CH4、C2H6的物质的量之比为2:3时,平均H原子数=$\frac{4×3+6×2}{2+3}$=4.8,满足条件,即C2H6、CH4的物质的量之比为2:3,
故选C.
点评 本题考查混合物反应的计算,题目难度不大,根据质量守恒定律正确计算混合烃的平均分子式为解答关键,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 温度升高,反应速率增大,产率增大 | |
| B. | 增大反应物H2的浓度,HI%增大 | |
| C. | 增大压强,浓度增大,平衡不移动 | |
| D. | 使用催化剂,反应速率增大,I2的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
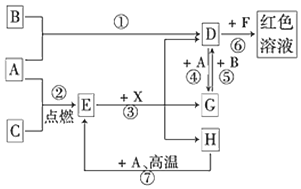
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
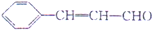 ),杏仁含苯甲醛(
),杏仁含苯甲醛(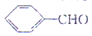 ).下列说法错误的是( )
).下列说法错误的是( )| A. | 肉桂醛和苯甲醛互为同系物 | |
| B. | 肉桂醛能发生加成反应、取代反应和加聚反应 | |
| C. | 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团 | |
| D. | 1mol肉桂醛分子在一定条件下最多与5mol氢气加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeSO4(aq)$\stackrel{氢气}{→}$Fe$→_{高温}^{H_{2}O(g)}$Fe2O3 | |
| B. | Cu2S$→_{高温}^{O_{2}}$Cu$\stackrel{FeCl_{3}(aq)}{→}$CuCl2(aq) | |
| C. | Ca(OH)2$\stackrel{Cl_{2}}{→}$Ca(ClO)2$→_{H_{2}O}^{SO_{2}(足量)}$HClO | |
| D. | Fe2O3$\stackrel{HCl(aq)}{→}$FeCl3(aq)$\stackrel{△}{→}$无水FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
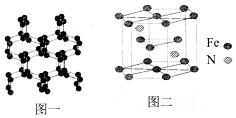 南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破.请根据材料回答以下问题:
南京理工大学化工学院胡炳成教授团队于2017年1月成功合成世界首个全氮阴离子盐,使氮原子簇化合物的研究又有了新的突破.请根据材料回答以下问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C7H12O4,4种 | B. | C7H12O4,6种 | C. | C7H14O2,8 种 | D. | C7H14O2,10种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用于消除H7N9病毒的漂白粉是一种强电解质 | |
| B. | 古代制盐(NaCl)有“东晒西煮”之说,是利用了复杂的物理、化学方法 | |
| C. | 铜带(镀锡)是光伏电池的电子元件,破损时不加快其腐蚀 | |
| D. | 纤维素、蛋白质和油脂均可发生水解,都属于天然高分子化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com