
 ,它表示( )
,它表示( )| A. | 氧原子 | B. | 氧离子 | C. | 氖原子 | D. | 钠离子 |
科目:高中化学 来源: 题型:选择题
| 物质 | 密度/(g•mL-1) | 沸点 | 水溶性 | 溶解性 |
| 甲 | 0.893 | 78.5℃ | 溶 | 溶于乙 |
| 乙 | 1.220 | 100.7℃ | 溶 | 溶于甲 |
| A. | 蒸馏 | B. | 升华 | C. | 分液 | D. | 过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 $→_{一定条件}^{Y}$
$→_{一定条件}^{Y}$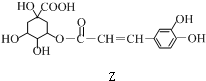
| A. | X分别与足量的Na、NaOH反应,消耗两者的物质的量之比为5﹕1 | |
| B. | Y的分子式为C9H8O3 | |
| C. | 1 mol Z与浓溴水反应最多消耗4molBr2 | |
| D. | 1 mol Z与足量NaOH溶液反应,最多消耗4mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ① | D. | ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:1 | B. | 7:2 | C. | 7:3 | D. | 7:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8种 | B. | 7种 | C. | 6种 | D. | 5种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com