
| A. | 20s内,H2的浓度改变0.60mol/L,表明该反应达到平衡状态 | |
| B. | 当气体总压强不随时间改变时,表明该反应达到平衡状态 | |
| C. | 使用催化剂会影响达到平衡的时间 | |
| D. | 达到化学平衡状态时,正、逆反应速率都为0且不再发生变化 |
分析 达到反应平衡状态时,在一定条件下的可逆反应里,正反应速率和逆反应速率相等,但是不等于0,反应混合物中各组成成分的百分含量保持不变,该反应就达到平衡状态,据此分析解答.
解答 解:A、20s内,H2的浓度改变0.60mol/L,不能说明正逆反应速率相等,不是平衡的特征,不能表明该反应达到平衡状态,故A错误;
B、反应前后气体系数和不等,所以当气体总压强不随时间改变时,表明该反应达到平衡状态,故B正确;
C、使用催化剂会加快反应速率,影响达到平衡的时间,故C正确;
D、达到化学平衡状态时,正、逆反应速率相等,但是都不为0,故D错误.
故选AD.
点评 本题考查化学平衡状态的判断,题目难度不大,明确只有当反应前后改变的物理量不变时,可逆反应才达到平衡状态.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 5:3 | B. | 5:4 | C. | 1:1 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 甲 | 乙 |
| ① | SO2 | 石灰水 |
| ② | CO2 | 石灰水 |
| ③ | SO2 | Ba(NO3)2 |
| ④ | NO2 | CaCl2 |
| A. | ②③④ | B. | ②③ | C. | ①③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素相对原子质量依次递增 | |
| B. | 元素的最高正化合价呈周期性变化 | |
| C. | 元素原子最外层电子排布呈周期性变化 | |
| D. | 元素金属性或非金属性呈周期性变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
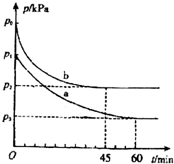 硫及其化合物对人类的生产和生活有着重要的作用.
硫及其化合物对人类的生产和生活有着重要的作用.| 实验编号 | 温度 | 起始时物质的量/mol | 平衡时物质的量/mol | |
| N(SO2) | N(NO2) | N(NO) | ||
| 甲 | T1 | 0.80 | 0.20 | 0.18 |
| 乙 | T2 | 0.20 | 0.80 | 0.16 |
| 丙 | T3 | 0.20 | 0.30 | a |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
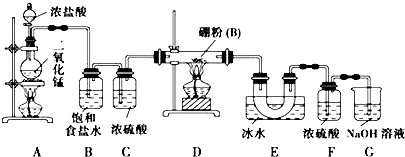
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷在氯气中燃烧产生大量的白烟,并放出热量 | |
| B. | 纯净的氢气在氯气中安静燃烧,发出黄色火焰 | |
| C. | 光照新制氯水有气泡逸出,该气体是Cl2 | |
| D. | 实验室制备氯气可用排饱和食盐水法收集 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com