
| A. | 原子半径比较:X<Y<Z<W | |
| B. | Y的氢化物沸点高于W的氢化物 | |
| C. | Y的氢化物稳定性一定弱于W的氢化物 | |
| D. | 短周期所有元素中,w的最高价氧化物的水化物酸性最强 |
分析 短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y、W同主族且能形成两种常见的化合物,则Y为O元素、W为S元素;X、W质子数之和是Z质子数的2倍,则Z的质子数为$\frac{6+16}{2}$=11,故Z为Na.
解答 解:短周期元素X、Y、Z、W的原子序数依次增大,X的最外层电子数是次外层电子数的2倍,原子只能有2个电子层,最外层电子数为4,故X为C元素;Y、W同主族且能形成两种常见的化合物,则Y为O元素、W为S元素;X、W质子数之和是Z质子数的2倍,则Z的质子数为$\frac{6+16}{2}$=11,故Z为Na.
A.同周期随原子序数增大原子半径减小,一般电子层越多原子半径越大,故原子半径O<C<S<Na,即Y<X<W<Z,故A错误;
B.水分子之间存在氢键,常温下为液态,沸点高于硫化氢的,故B正确;
C.过氧化氢易分解,但氧元素非金属性比硫的强,水的稳定性比较硫化氢的强,故C错误;
D.短周期所有元素中,Cl元素的最高价氧化物的水化物酸性最强,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,根据原子结构特点与Y、W同主族可以形成两种常见化合物推断元素,注意氢键对物质性质的影响,难度中等.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
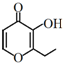 俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌.“一滴香”的分子结构如图所示,下列说法正确的是( )| A. | lmol该有机物最多能与2molH2发生加成反应 | |
| B. | 该有机物的分子式为C7H8O3 | |
| C. | 该有机物能发生取代反应、加成反应、消去反应和氧化反应 | |
| D. | 该有机物的一种芳香族同分异构体能发生银镜反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Cu | Cu2O | CuO | Cu(OH)2 | CuSO4•5H2O |
| 红色(或紫红色) | 红色(或砖红色) | 黑色 | 蓝色 | 蓝色 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
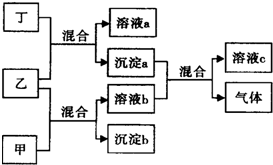 现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):
现有四瓶贴有甲、乙、丙、丁标签的溶液,它们可能是K2CO3、Ba(NO3)2、NaHSO4和K2SO4溶液.现进行如下实验,并记录部分现象(如图):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③ | C. | ①③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
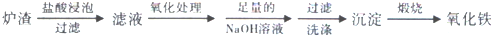
| A. | Al | B. | Al(OH)3 | C. | Al3+ | D. | [Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它能与Na、NaOH、NaHC03等物质反应 | B. | 它能发生酯化、氧化、加成等反应 | ||
| C. | 该有机物分子式为C5H8O3 | D. | 它是乙酸也是乙醇的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为56,中子数为30 |
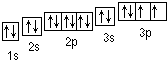 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com