
【题目】固定容积为2L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是( )
zC(g),图I表示t℃时容器中各物质的量随时间的变化关系,图II表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是( )
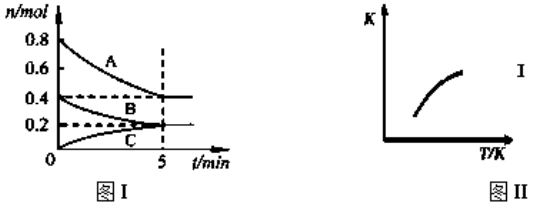
A.该反应可表示为:2A(g)+B(g)![]() C(g) ΔH﹤0
C(g) ΔH﹤0
B.t℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.t℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
【答案】D
【解析】
试题分析:A.由图Ⅰ可知,该反应为2A(g)+B(g)![]() C(g),由图Ⅱ可知,当温度升高时,平衡常数K增大,证明反应正向移动,因此该反应正向为吸热反应,即ΔH>0,A错误;B. t℃时物质A的平衡浓度为0.2mol/L,B的平衡浓度为0.1mol/L,C的平衡浓度为0.1mol/L,故该反应的平衡常数K=0.1/(0.22×0.1)=25,B错误;C.根据质量守恒可知,反应前后,气体的质量保持不变,由于容器的体积不变,因此反应前后气体的密度不发生变化,故当容器中气体的密度不再发生变化时,不能证明该反应达到平衡状态,C错误;D.t℃,达到平衡状态时,C的体积分数为0.25,在第6 min时再向体系中充入0.4 mol C,平衡逆向移动,但是0.4molC不能完全转化为A和B,因此再次达到平衡时C的体积分数大于0.25,D正确。故答案D。
C(g),由图Ⅱ可知,当温度升高时,平衡常数K增大,证明反应正向移动,因此该反应正向为吸热反应,即ΔH>0,A错误;B. t℃时物质A的平衡浓度为0.2mol/L,B的平衡浓度为0.1mol/L,C的平衡浓度为0.1mol/L,故该反应的平衡常数K=0.1/(0.22×0.1)=25,B错误;C.根据质量守恒可知,反应前后,气体的质量保持不变,由于容器的体积不变,因此反应前后气体的密度不发生变化,故当容器中气体的密度不再发生变化时,不能证明该反应达到平衡状态,C错误;D.t℃,达到平衡状态时,C的体积分数为0.25,在第6 min时再向体系中充入0.4 mol C,平衡逆向移动,但是0.4molC不能完全转化为A和B,因此再次达到平衡时C的体积分数大于0.25,D正确。故答案D。


科目:高中化学 来源: 题型:
【题目】白磷与氧气可发生如下反应:P4+5O2 = P4O10。已知断裂下列化学键需要吸收的能量分别为:E(P—P) = a kJ·mol-1、E(P—O) = b kJ·mol-1、E(P=O) = c kJ·mol-1、E(O=O) = d kJ·mol-1。根据图示的分子结构和有关数据估算该反应的ΔH,其中正确的是( )
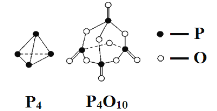
A.-(6a-12b-4c+5d)kJ·mol-1
B.-(-6a+12b+4c-5d)kJ·mol-1
C.-(-4a+6b+4c-5d)kJ·mol-1
D.-(4a-6b-4c+5d)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在不同状态下(固态或气态)与氢气反应的热化学方程式如下所示:
①H2(g)+I2(?)![]() 2HI(g)ΔH=+9.48kJ·mol-1
2HI(g)ΔH=+9.48kJ·mol-1
②H2(g)+I2(?)![]() 2HI(g)ΔH=-26.48kJ·mol-1
2HI(g)ΔH=-26.48kJ·mol-1
下列判断正确的是( )
A.①中的I2为固态,②中的I2为气态
B.①的反应物总能量比②的反应物总能量高
C.①的产物比反应②的产物热稳定性更好
D.1mol固态碘升华需吸热17kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或事故处理正确的是( )
A. 金属钠着火,立即用水扑灭
B. 实验结束后,用嘴吹灭酒精灯
C. 皮肤上不慎沾上NaOH溶液,立即用盐酸冲洗
D. 稀释浓硫酸时,将浓硫酸沿器壁慢慢注入水中,并不断搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤素是最活泼的一族非金属元素,下列关于卤素(用X表示)的叙述正确的是
A. 常温下卤素单质均能与水反应生成HXO
B. 从上到下,卤素离子的电子层数依次增多,还原性逐渐增强
C. 从上到下,HX的氧化性增强,对应水溶液酸性增强
D. 卤素均能形成最高价含氧酸,其分子通式为HXO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源与我们日常生活密切相关,下列有关能源的叙述中错误的是
A.我国目前使用的主要能源是化石燃料
B.提高燃料的燃烧效率对于节约能源十分重要
C.科学家正在研究开发太阳能、风能、潮汐能等新能源,并取得了一定进展
D.氢能是一种理想的绿色能源,现在的科技水平已经能够全面推广使用氢能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将0.2mol/L HA 溶液与 0.1mol/L NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A),则(用“>”、“<”或“=”填写下列空白):
①混合溶液中c(A)_________c(HA);
②混合溶液中c(HA) + c(A) 0.1mol/L;
(2)常温时,取0.1molL-1 HX溶液与0.1molL-1 NaOH溶液等体积混合(混合后溶液体积的变化不计)测得混合溶液的pH=8,试回答以下问题:
①混合溶液中由水电离出的c(OH-)与0.1molL-1 NaOH溶液中由水电离出的c(OH-)之比为 .
②已知NH4X溶液是中性,又知将HX溶液加入到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH__________7(选填“>”、“<”或“=”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com