
已知A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,B和A同族且位于A的下一周期,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,E的基态原子核外成对电子数是未成对电子数的3倍,F与E不同周期且F在其周期中的电负性最大,G原子d轨道有7个电子.
请回答下列问题:
(1)G基态原子的核外电子排布式是 ;
(2)C、D、E的第一电离能由大到小的顺序是:
(3)下列有关上述元素的说法中,不正确的是 (填字母)
a.B单质的熔点在同族单质中最高
b.1mol A 2E的晶体中含有4mol氢键
c.SiO44-与FE4-互为等电子体
d.C3 A6直链分子中C原子采取sp、sp3两种杂化方式
(4)ACD分子中含 个σ键。
(5)GCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则该配合物的化学式为 ;
(6)C的单质是一种层状结构,B的离子位于C单质的层间、其投影位于层面内六圆环的中央,B和C 形成一种化合物,“?”表示B离子的位置,平行四边形表示在此二维图形上画出的一个晶胞.则该化合物的化学式为 。

(1)1s22s22p63s23p63d74s2
(2)D>E>C
(3)bd
(4)2
(5)[CoCl(NH3)5]Cl2
(6)LiC6
【解析】A、B、C、D、E、F、G七种元素,G原子核外有四个电子层,其余原子至多只有三个电子层,且原子序数依次递增.A、B、F位于周期表的s区,A原子中电子层数和未成对电子数相同,且属于S区,原子序数最小,则A是H元素,B和A同族且位于A的下一周期,则B是Li元素,C元素基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则C是C元素;E的基态原子核外成对电子数是未成对电子数的3倍,E是O元素,则D是N元素,F与E不同周期且F在其周期中的电负性最大,则F是Cl元素,G原子d轨道有7个电子,则G是Ni元素。
(1)G是钴元素,其核外有27个电子,根据构造原理知,其核外电子排布式为:1s22s22p63s23p63d74s2。
(2)C是C元素,D是N元素,E是O元素,同一周期元素,元素的第一电离能随着原子序数的增大而呈增大的趋势,但第VA族元素第一电离能大于第VIA族元素,所以C、N、O的第一电离能大小顺序是:D>E>C。
(3)a.碱金属族元素单质的熔点随着原子序数的增大而减小,所以Li单质的熔点在同族单质中最高,故正确;
b.1molH2O的晶体中含有2mol氢键,故错误;
c.SiO44-与ClO4-互为原子个数和价电子数相等,所以是等电子体,故正确;
d.C3H6直链分子中,甲基上C原子采取sp3杂化,碳碳双键两端的碳原子采用sp2杂化,故错误;故选b d;
(4)HCN分子的结构简式为:H-C≡N,所以HCN中含有2个??键,。
(5)CoCl3能与NH3反应形成一种六配位的配合物,两个氯离子位于外界,则一个氯原子位于內界,其配位数是6,则该配合物还含有5个氨气分子位于內界,所以该配合物的化学式为[CoCl(NH3)5]Cl2。
(6)C的单质是一种层状结构,Li的离子位于C单质的层间、其投影位于层面内六圆环的中央,Li和C 形成一种化合物,“?”表示B离子的位置,该晶胞中锂离子个数=4×1/4=1,碳原子个数=2+8×1/2=6,所以其化学式为:LiC6。


科目:高中化学 来源:2014高考名师推荐化学--预测13 题型:选择题
关于下列各图的叙述,正确的是


A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g)  N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由t1 ℃升温至t2 ℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液的pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测11 题型:选择题
下列与有机物结构、性质相关的叙述正确的是
A.乙醇分子和水分子中都含有羟基,均可与金属钠反应生成氢气
B.苯和乙烯分别与酸性高锰酸钾溶液混合,现象相同
C.淀粉和纤维素均为多糖,属于同分异构体
D.石油的分馏、煤的干馏、煤的气化和液化均为物理变化
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
右图所示装置中,a、b、c、d、e、f均为惰性电极,电解质溶液均足量。接通电源后,d极附近显红色。下列说法正确的是

A.电源B端是正极
B.a、c电极均有单质生成,其物质的量之比为2:1
C.欲用丁装置给铜镀银,N应为Ag,电解液为AgNO3溶液
D.f极附近变红,说明氢氧化铁胶粒带正电荷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测10 题型:选择题
下列说法正确的是
①向50mLl8mol·L-1的H2SO4溶液中加人足量的铜片加热充分反应后,被还原的H2SO4的物质的量等于0.45mol
②标准状况下,0.5NA个NO和0.5NA个O2混合气体的体积约为22.4 L
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤在使Al溶解产生H2的溶液中能大量存在:NH4+、Na+、Fe2+、NO3-
A.①②③⑤
B.①③④
C.④
D.③④
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测1 题型:选择题
金属锌为活泼金属,易被腐蚀。下列关于锌的腐蚀说法正确的是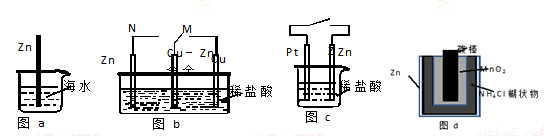
A.图a中,??入海水中的锌棒,越靠近底端腐蚀越严重
B.图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D.图d中,Zn-MnO2干电池自放电腐蚀主要是由Zn的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测 题型:选择题
2013年CCTV-4报道地球空气温度和30年前相比升高1.5 ℃左右,为控制温室效应,可以将二氧化碳转化为化工原料,如在适当的条件下,二氧化碳和氢气以1︰3的体积比进行反应,可生成某类重要的化工原料和水,则该类化工原料不可能是
A.甲醇(CH3OH)
B.乙烯
C.乙醇
D.甲烷
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--线索综合4 题型:简答题
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ | 用炭粉在高温条件下还原CuO |
方法Ⅱ | 电解法,反应为2Cu + H2O |
方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是反应条件不易控制,若控温不当易生成 而使Cu2O产率降低。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s) △H =-akJ·mol-1
C(s)+1/2O2(g)=CO(g) △H =-bkJ·mol-1
Cu(s)+1/2O2(g)=CuO(s) △H =-ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H = kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极生成Cu2O反应式为 。

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,该制法的化学方程式为 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
水蒸气的浓度(mol/L)随时间t(min)变化如下表所示。
序号 | 温度 | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是 (填字母代号)。
A.实验的温度T2小于T1
B.实验①前20 min的平均反应速率v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
查看答案和解析>>
科目:高中化学 来源:2014江苏常熟市高二化学期末模拟4(必修2、选修4、结构)试卷(解析版) 题型:选择题
一定条件下存在反应:CO(g)+H2O(g) CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2 和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
CO2(g)+H2(g),其正反应放热。现有三个相同的2L恒容绝热(与外界没有热量交换) 密闭容器Ⅰ、Ⅱ、Ⅲ,在Ⅰ中充入1 mol CO和1 mol H2O,在Ⅱ中充入1 mol CO2 和1 mol H2,在Ⅲ中充入2 mol CO 和2 mol H2O,700℃条件下开始反应。达到平衡时,下列说法正确的是
A.容器Ⅰ、Ⅱ中正反应速率相同
B.容器Ⅰ、Ⅲ中反应的平衡常数相同
C.容器Ⅰ中CO 的物质的量比容器Ⅱ中的多
D.容器Ⅰ中CO 的转化率与容器Ⅱ中CO2 的转化率之和小于1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com