
| 温度/℃ | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强/kPa | 5.7 | p1 | 12.0 | p2 | 24.0 |
| 平衡气体总浓度/10-3mol•L-1 | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
| A. | 混合气体的平均相对分子质量$\overline{M}$不再随时间变化的反应达到平衡状态 | |
| B. | 15.0℃时NH2COONH4(s)分解的平衡常数为2.0×10-9(mol/L)3 | |
| C. | 该反应△H>0,p2=2p1 | |
| D. | 若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)均比原平衡大 |
分析 A.只有生成物为气体,且物质的量之比为2;1,无论是否达到平衡状态,平均相对分子质量都不变;
B.15.0℃时平衡气体总浓度2.4×/10-3mol•L-1,则c(NH3)=1.6×/10-3mol•L-1,c(CO2)=0.8×/10-3mol•L-1,以此计算平衡常数;
C.温度升高,气体浓度增大,说明平衡正向移动,p1、p2时浓度分别为3.4×10-3mol•L-1、6.810-3mol•L-1,如温度相等,则p2=2p1,但时温度较高p2,则p2>2p1;
D.因温度不变,平衡常数不变,c(NH3)和c(CO2)都不变.
解答 解:A.只有生成物为气体,且物质的量之比为2;1,无论是否达到平衡状态,平均相对分子质量都不变,不能作为判断是否达到平衡的依据,故A错误;
B.15.0℃时平衡气体总浓度2.4×/10-3mol•L-1,则c(NH3)=1.6×/10-3mol•L-1,c(CO2)=0.8×/10-3mol•L-1,NH2COONH4(s)分解的平衡常数为(1.6×/10-3)2×(0.8×/10-3)=2.0×10-9,故B正确;
C.温度升高,气体浓度增大,说明平衡正向移动,则该反应△H>0,p1、p2时浓度分别为3.4×10-3mol•L-1、6.810-3mol•L-1,如温度相等,则p2=2p1,但时温度较高p2,则p2>2p1,故C错误;
D.因温度不变,平衡常数不变,且只有生成物为气体,物质的量之比为2;1,则若在恒温下将平衡体系体积减半,再达平衡后,c(NH3)和c(CO2)都不变,故D错误.
故选B.
点评 本题综合考查化学平衡计算以及平衡移动温度,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意把握反应特点以及平衡移动的影响因素,难度不大.


 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:实验题
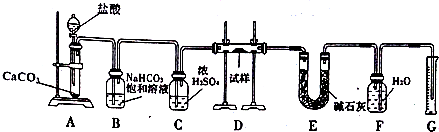
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Z2- | |
| C. | 同主族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.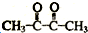 ,A→B的反应类型为氧化反应.
,A→B的反应类型为氧化反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
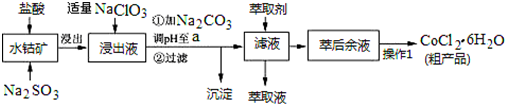
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
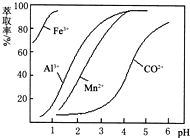
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
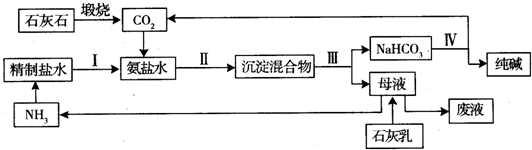
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2mol H2完全燃烧时液态水放热572kJ | |
| B. | 相同条件下,2mol H2O完全分解吸收热量572kJ | |
| C. | 相同条件下,1mol H2充分燃烧生成气态水放热大于286kJ | |
| D. | 形成1mol H2O的化学键所释放的能量大于断裂lmol H2和0.5mol O2的化学键所吸收的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 洗净的锥形瓶和容量瓶可以放进烘箱中烘干 | |
| B. | 滴定管装滴定液前应先用该溶液润洗 | |
| C. | 分液漏斗和蒸馏烧瓶使用前都要检查是否漏液 | |
| D. | 配制溶液时,只要容量瓶的容积符合要求就可以直接使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com