
【题目】实验室利用反应TiO2(s)+CCl4(g)![]() TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
TiCl4(g)+CO2(g),在无水无氧条件下制备TiCl4,实验装置示意图如下:
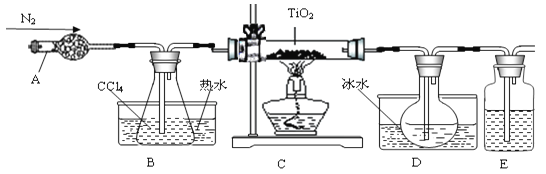
有关物质性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其他 |
CCl4 | -23 | 76 | 与TiCl4互溶 |
TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(1)仪器A的名称是 ,装置E中的试剂是 。反应开始前依次进行如下操作:组装仪器、 、加装药品、通N2一段时间后点燃酒精灯。
(2)反应结束后的操作包括:a停止通N2;b熄灭酒精灯;c冷却至室温。正确的顺序为 (填序号)。选择这种顺序的理由是 ; 欲分离D中的液态混合物,所采用操作的名称是 。
【答案】(1)干燥管(1分) 浓H2SO4(2分) 检查气密性(2分)
(2)bca(2分) 蒸馏(1分)
【解析】
试题分析:(1)仪器A的名称是球形干燥管,仪器B的作用是加热CCl4,使整个装置充满四氯化碳蒸汽;E的作用是防止空气中的水蒸气进入D装置,防止四氯化钛遇潮湿空气产生白雾,因此该洗气瓶中所盛试剂为液态干燥剂,因此常用浓硫酸防止TiCl4潮解;任何有气体参加的反应或制备气体的反应,在反应开始前都要检查装置的气密性;(2)反应结束后,正确的操作顺序是b熄灭酒精灯、c却至室温、a停止通氮气;由表中熔沸点数据信息可知,-25 < -23 < 25 < 76 < 136,说明常温常压下TiCl4和CCl4均为液体,二者组成互溶的液态混合物,但两组分的沸点不同且相差较大(超过30℃),由混合物分离提纯的物理方法可知,分离二者的方法是蒸馏。


科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的化学装置、部分反应现象如下:
实验装置 |
|
|
|
|
实验现象 | a极质量减小, b极质量增加 | b极有气体产生,c极无变化 | d极溶解,c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. b>c>d>a C. a>b>d>c D. d>a>b>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂。硫代硫酸钠(Na2S2O3)可由亚硫酸钠和硫粉通过化合反应制得,装置如图1所示。
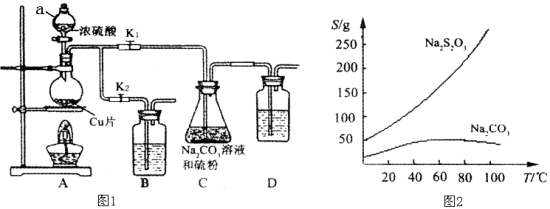
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示,
(1)Na2S2O3·5H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装置气密性的操作是 。
步骤2:加入药品,打开K1、关闭K2,加热。装置B、D中的药品可选用下列物质中的 (填编号)。
A.NaOH溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的量逐渐减少。
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液 、过滤、洗涤、烘干,得到产品。
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 。
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00 mL,控制适当的酸度加入足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解。此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010 mol·L-1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18. 00 mL。部分反应的离子方程式为:Cr2O72- + 6 I- + 14H+ = 2 Cr3+ + 3 I2 + 7 H2O;I2 + 2 S2O32- = S4O62-+2I-。则该废水中Ba2+的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列变化:①碘的升华;②氧气溶于水;③氯化钠溶于水;④烧碱熔化;⑤氯化氢溶于水;⑥氯化铵受热分解。(填序号)
化学键没有被破坏的是________;仅发生离子键破坏的是_______ ; 仅发生共价键破坏的是________;既发生离子键又发生共价键破坏的是_______。
(2)已知1mol Si中含1mol Si—Si键。
化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
键能/ kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
请回答下列问题:
①已知Si、SiC、SiO2熔化时必须断裂所含化学键,比较下列物质的熔点高低(填“>”或“<”):SiC________Si。
②工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
Si(s)+4HCl(g),则2 mol H2生成高纯硅需________(填“吸收”或“放出”)能量________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50 mL物质的量浓度为4.4 mol/L,密度为1.24 g/mL的稀硫酸的质量分数为( )
A.35%
B.70%
C.17.5%
D.0.035%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、W四种元素,X、Z基态原子的2p原子轨道上均有2个未成对电子,W基态原子的除第四层只有1个电子外,其余内层均为全满结构。
(1)W基态原子的价电子排布式为 。元素X、Y、Z的第一电离能由小到大顺序是 (填元素符号)。
(2)与XYZ-互为等电子体的一种分子为 (填化学式)。
(3)1 mol H2XZ3分子中含有σ键的数目为 。
(4)YH3极易溶于水的主要原因是 。
(5)尿素(H2NCONH2)可用于制有机铁肥,主要代表有 [Fe(H2NCONH2)6](NO3)3 [三硝酸六尿素合铁(Ⅲ)]。
①尿素分子中C、N原子的杂化方式分别是 。
②[Fe(H2NCONH2)6](NO3)3中“H2NCONH2”与Fe(Ⅲ)之间的作用力是 。根据价层电子对互斥理论推测NO3—的空间构型为 。
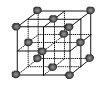
(6)CO2和NH3是制备尿素的重要原料,固态CO2(干冰)的晶胞结构如图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有 个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比为是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂;其分子结构中如图所示,S2Cl2能和水反应2S2Cl2+2H2O=SO2↑+3S↓+4HCl下列说法中错误的是
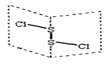
A. 反应中SO2是还原产物,S是氧化产物
B. S2Cl2分子中既有极性键又有非极性键
C. S2Cl2的结构式为Cl-S-S-Cl
D. S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H9ClO2的有机物,能与NaHCO3溶液反应生成气体,则符合此条件的结构(不考虑立体异构)有
A. 9种 B. 10种 C. 11种 D. 12种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com