
【题目】次磷酸![]() 是一种具有强还原性的一元弱酸,工业上常利用
是一种具有强还原性的一元弱酸,工业上常利用![]() 和
和![]() 溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中正确的是
溶液反应进行化学镀银,已知该反应中氧化剂与还原剂的物质的量之比为4:1,则下列说法中正确的是![]()
A.![]() 中磷元素的化合价为
中磷元素的化合价为![]()
B.![]() 的电离方程式为
的电离方程式为![]()
C.![]() 被
被![]() 氧化成了
氧化成了![]()
D.![]() 、
、![]() 、
、![]() 均为酸式盐
均为酸式盐
【答案】C
【解析】
根据次磷酸![]() 是一种具有强还原性的一元弱酸,结合化学镀银时氧化剂与还原剂物质的量之比进行分析。
是一种具有强还原性的一元弱酸,结合化学镀银时氧化剂与还原剂物质的量之比进行分析。
![]() 中H为
中H为![]() 价,O为
价,O为![]() 价,根据化合物中元素的正负化合价代数和为0,则磷元素的化合价为
价,根据化合物中元素的正负化合价代数和为0,则磷元素的化合价为![]() ,故A错误;
,故A错误;
B.次磷酸是一元弱酸,一元弱酸部分电离出一个氢离子,所以![]() 的电离方程式为
的电离方程式为![]() ,故B错误;
,故B错误;
C.![]() 中,氢元素为
中,氢元素为![]() 价,氧元素为
价,氧元素为![]() 价,依据化合物中元素的正负化合价代数和为0,磷元素的化合价为+1价,该反应中
价,依据化合物中元素的正负化合价代数和为0,磷元素的化合价为+1价,该反应中![]() 为氧化剂,
为氧化剂,![]() 为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,
为还原剂,氧化剂与还原剂的物质的量之比为4:1,设反应产物中P的化合价为x,根据化合价升降相等可得,![]() ,解得x=+5,所以氧化产物为
,解得x=+5,所以氧化产物为![]() 价的
价的![]() ,故C正确;
,故C正确;
D.![]() 是一元弱酸,
是一元弱酸,![]() 是正盐,
是正盐,![]() 、
、![]() 均为酸式盐,故D错误;
均为酸式盐,故D错误;
答案选C。


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:
【题目】固体化合物CaFe(CO3)2在空气中加热反应生成CO2、Fe2O3和CaO.回答下列问题:
(1)CO2的电子式为_____。
(2)上述反应产物中的CaO加入燃煤中,其作用是_____。
A.降低温室效应B.减少SO2的排放C.避免光化学烟雾D.保护臭氧层
(3)设计实验证明上述固体产物中含有三价铁:取少量固体于试管中,_____。
(4)CaFe(CO3)2在空气中加热反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是( )
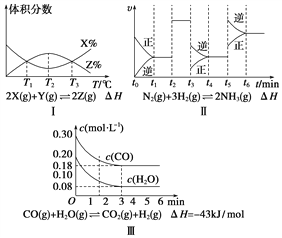
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的ΔH<0
B. 由图Ⅱ知,反应在t6时刻,NH3体积分数最大
C. 由图Ⅱ知,t3时采取增大反应体系压强的措施
D. 若图Ⅲ表示在10 L容器、850℃时的反应,由图知,到4 min时,反应放出51.6 kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四幅图示所表示的信息与对应的叙述相符的是( )
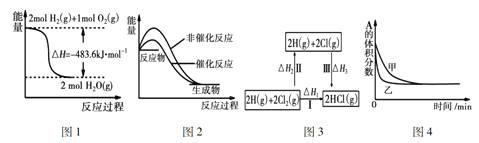
A. 图1表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为241.8kJ·mol—1
B. 图2表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化
C. 图3表示一定条件下H2和Cl2生成HCl的反应热与途径无关,则 △H1=△H2+△H3
D. 图4表示压强对可逆反应2A(g)+2B(g)![]() 3C(g)+D(s)的影响,乙的压强大
3C(g)+D(s)的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵[(NH4)2SO4]一种优良的氮肥(俗称肥田粉),适用于一般土壤和作物,能使枝叶生长旺盛,提高果实品质和产量,增强作物对灾害的抵抗能力,可作基肥、追肥和种肥,与氢氧化钙在加热的条件下可以生成氨气。根据所学知识回答下列问题:
(1)基态S原子的价电子排布式为____________,能量最高的电子所处的能层的符号为_________。
(2)SO42-空间构型为__________,中心原子的轨道杂化方式是________,写出一个与SO42-互为等电子体的分子的化学式__________。
(3)氨气的沸点(-33.5℃)高于硫化氢的沸点(-60.4℃)的主要原因是:_____________________________。
(4)O、N、S的第一电离能从大到小的顺序是___________________。
(5)硫酸铜溶液中通入过量的氨气会生成[Cu(NH3)4]SO4,1mol的[Cu(NH3)4]2+中σ键的个数为________。
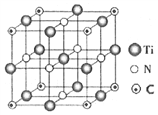
(6)以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。其结构如下图所示,这种碳氮化钛化合物的化学式为________。若将该晶体的晶胞重新切割,使碳原子位于新晶胞的上下面心,则氮原子在新晶胞中的位置是__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应mA(固)+nB(气)![]() pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是
pC(气)+qD(气),反应过程中其它条件不变时C的百分含量C%与温度(T)和压强(P)的关系如图所示,下列叙述中正确的是

A. 达到平衡后,使用催化剂,C%将增大
B. 达到平衡后,若升高温度、化学平衡向逆反应方向移动
C. 方程式中n>p+q
D. 达到平衡后,增加A的量有利于化学平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】B、N、Co均为新型材料的重要组成元素。请回答下列问题。
(1)基态氮原子的价电子排布图为________________。
(2)Co能形成[Co(CNO)6]3-。
①1mol该离子中含有σ 键的数目为_____________。
②与CNO—互为等电子体的分子为_____________。(任写一种,填化学式)
(3)往CuSO4溶液中加入过量氨水,可生成[Cu(NH3)4]2+ 配离子,已知NF3和NH3的空间构型都是三角锥型,但NF3不易与Cu2+形成配合离子,其原因是_______。
(4)分子中的大 π键可用符合 πmn 表示,其中m表示形成大 π 键的原子数,n表示参与形成大 π 键的电子数(如苯分子中的大 π键可表示为π66)。则NO3-中的大 π键应表示为________________。
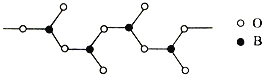
(5)多硼酸根的结构之一为链状(如图),其化学式为____________。
(6)氮化硼晶体有多种结构,其中立方氮化硼具有金刚石的结构(如图)。若晶胞边长为a nm,晶胞中N原子位于B原子所形成的正四面体的体心,则B—N键的键长为____nm,这种氮化硼晶体的密度为______g/cm3 。(用含有a和NA的代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)高铁酸钾( K2FeO4)不仅是一种理想的水处理剂(胶体),而且高铁电池的研制也在进行中。如图1是高铁电池的模拟实验装置:

①该电池放电时正极的电极反应式为____________________________________;
②盐桥中盛有饱和KCl溶液,此盐桥中氯离子向________(填“左”或“右”)移动;若用阳离子交换膜代替盐桥,则钾离子向______(填“左”或“右”)移动。
③图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有_____________________________________________________________。
(2)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示,电池正极的电极反应式是____________________,A是____________。

(3)利用原电池工作原理测定汽车尾气中CO的浓度,其装置如图所示。该电池中O2-可以在固体介质NASICON(固溶体)内自由移动,工作时O2-的移动方向________(填“从a到b”或“从b到a”),负极发生的电极反应式为___________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业中电解饱和食盐水的原理示意图如图:
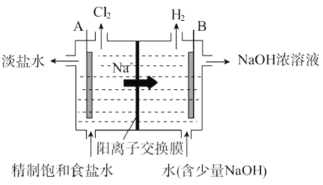
(1)电极 A 是_________(填“阴极”或“阳极”),判断依据为_________。
(2)写出电极 B 的电极反应式_________。
(3)写出电解饱和食盐水的化学方程式_________。
(4)一段时间后,电极 B 周围 NaOH 稀溶液转变为浓溶液,原因:_________。
(5)电解时,工业用盐酸调节 A 室的 pH=2~3,请用化学平衡原理解释原因_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com