
| A. | 稳定性:HF>HCl>HBr>HI | B. | 酸性:H4SiO4<H3PO4<H2SO4<HClO4 | ||
| C. | 粒子半径:Al3+>Mg2+>Na+>F- | D. | 碱性:Al(OH)3<Mg(OH)2<Ca(OH)2<KOH |
分析 A.非金属性越强,气态氢化物的稳定性越强;
B.非金属性越强,最高价含氧酸的酸性越强;
C.四种离子的电子层相同,核电荷数越大,离子半径越小;
D.金属性越强,最高价氧化物对应水合物的碱性越强.
解答 解:A.非金属性F>Cl>Br>I,则稳定性大小为:HF>HCl>HBr>HI,故A正确;
B.非金属性:Si<P<S<Cl,则最高价氧化物对应水合物的酸性:H4SiO4<H3PO4<H2SO4<HClO4,故B正确;
C.Al3+、Mg2+、Na+、F-都含有2个电子层,核电荷数越大,离子半径越小,则离子半径大小为:Al3+<Mg2+<Na+<F-,故C错误;
D.金属性Al<Mg<Ca<K,则最高价氧化物对应水合物的碱性强弱为::Al(OH)3<Mg(OH)2<Ca(OH)2<KOH,故D正确;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度不大,明确元素周期律的内容为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
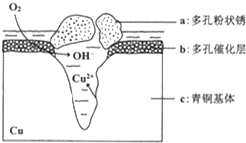 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度 | 283K | 293K | 303K |
| 溶解度(g/100g H2O) | 2.5 | 3.9 | 5.6 |
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀. | |
| 步骤2:取适量滤液于试管中,滴加稀硫酸. | 出现白色沉淀,说明该试剂中有Ba2+存在 |
| 步骤3:取适量步骤1中的沉淀于试管中,滴加稀盐酸连接带塞导气管将产生的气体导入澄清石灰水中. | 澄清石灰水变混浊.说明该试剂中含有BaCO3 |
| 步骤4:取步骤1中的滤液于烧杯中,用pH计测其pH值 | pH值明显大于9.6,说明该试剂中含有Ba(OH)2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②⑤⑥ | C. | ①②③④ | D. | ④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
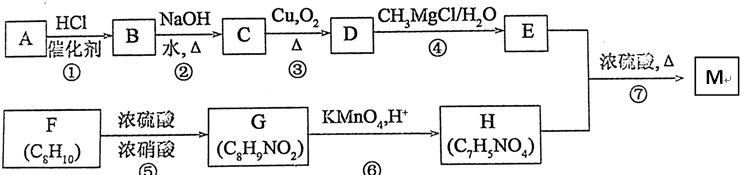
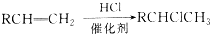


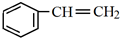 ,C中官能团的名称为羟基.
,C中官能团的名称为羟基.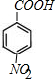 +
+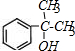 $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O. 、
、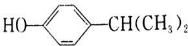 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 g 氦气所含有的原子数目是0.25 NA | |
| B. | 常温常压下,0.5 mol Cl2所占有的体积约为11.2 L | |
| C. | 标准状况下,0.9 mL水的质量约为0.9 g | |
| D. | 0.5 mol/L Na2SO4 溶液中Na+ 的物质的量是1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、Cl2、H2S | B. | O2、H2、SO2 | C. | CH4、HCl、NH3 | D. | NO、SO3、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
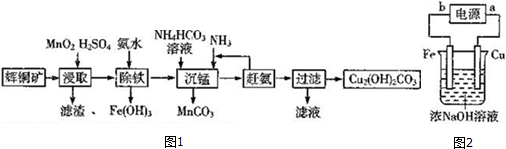
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯与溴单质加成的产物只有2种 | |
| B. | 酚酞( )属于醇 )属于醇 | |
| C. | 可以用溴水将四氯化碳和乙醇鉴别开来 | |
| D. | 分子组成相差一个或若干个CH2原子团的化合物肯定互为同系物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com