

| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| 温度(℃) | 30 | 40 | 50 | 60 | 70 |
| 显色时间(s) | 160 | 80 | 40 | 20 | 10 |
分析 (1)①甲中阴离子不同;
②将注射器活塞拉出一定距离,观察活塞是否移动检验气密性;利用单位时间内气体的体积判断速率;
(2)①酸性高锰酸钾溶液和草酸溶液反应生成硫酸钾、硫酸锰、二氧化碳和水;
②锰离子对反应起催化剂作用;
(3)①碘离子在酸性条件下能与氧气反应,生成碘和水;
②淀粉遇单质碘变蓝;
③由表格中数据可知,温度升高10℃,时间减少1半.
解答 解:(1)①实验不能说明Fe3+比Cu2+对H2O2分解的催化效果更好,因两催化剂的阴离子不同,
故答案为:否;两催化剂的阴离子不同;
②检验该装置的气密性的方法为关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,如活塞复原则装置的气密性良好;实验中需要测量的数据是产生40ml气体所需的反应时间,
故答案为:关闭A处活塞,将注射器活塞拉出一定距离,一段时间后松开活塞,如活塞复原则装置的气密性良好;产生40ml气体所需的反应时间;
(2)①酸性高锰酸钾溶液和草酸溶液反应的化学方程式为2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,故答案为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑;
②KMnO4与草酸的反应是放热反应,导致溶液温度升高,反应速率加快.从影响化学反应速率的因素看,你的猜想还可能是催化剂(或硫酸锰、Mn2+)的作用,选择硫酸锰作对比性实验可说明,
故答案为:催化剂;B;
(3)①碘离子在酸性条件下能与氧气反应,生成碘和水,则离子反应为4H++4I-+O2═2I2+2H2O,
故答案为:4H++4I-+O2═2I2+2H2O;
②淀粉遇单质碘变蓝,则选择试剂为淀粉溶液,实验现象为无色溶液变蓝色,
故答案为:淀粉溶液;无色溶液变蓝色;
③由表格中数据可知,温度升高10℃,时间减少1半,则由上述实验记录数据可得出的结论是其他条件不变,每升高100C,反应速率大增大2倍,
故答案为:其他条件不变,每升高100C,反应速率大增大2倍.
点评 本题考查探究影响反应速率的因素,为高频考点,把握催化剂、温度对反应速率的影响为解答的关键,侧重分析与实验能力的考查,注意控制变量法的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
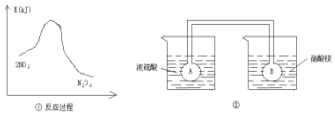 利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体.B瓶中的气体颜色比A瓶中的浅(填“深”或“浅”),其原因是2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅.
利用图①中的信息,按图②装置链接的A、B瓶中已充有NO2气体.B瓶中的气体颜色比A瓶中的浅(填“深”或“浅”),其原因是2NO?N2O4△H<0,A瓶加热,平衡左移颜色加深,B瓶降低温度,平衡右移颜色变浅.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③④ | C. | ②④ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液:Cu2+、H+、Cl-、NO3- | |
| B. | 含有HCO3-的溶液中:K+、OH-、NO3-、Ba2+ | |
| C. | 能与金属Al反应放出H2的溶液中:Na+、NO3-、SO42-、CO32- | |
| D. | 能使酚酞试液呈红色的溶液:Na+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绚丽缤纷的烟花中可能添加了含钾、钠、钙、铜等某些金属元素的物质 | |
| B. | 回收废弃塑料制成燃油替代汽油、柴油,可减轻环境污染和节约化石能源 | |
| C. | 为防止电池中的重金属等污染土壤和水体,应积极开友废电池的综合利用技术 | |
| D. | 生铁炼钢时必须完全除去生铁中的碳,以避免因钢铁中含有碳而发生电化学腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com