
 .
.分析 (1)苯与液溴在溴化铁做催化剂条件下发生取代反应生成溴苯和溴化氢;
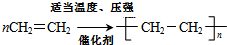
(2)乙烯中含双键,可发生加聚反应;
(3)乙酸与CH3CH218OH发生酯化反应,酸去羟基,醇去氢;
(4)乙烯的与Br2的加成反应生成1,2-二溴乙烷.
解答 解:(1)在催化剂的作用下,苯环上的氢原子被溴原子所取代,生成溴苯,同时有溴化氢生成,反应为C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr,
故答案为C6H6+Br2$\stackrel{FeBr_{3}}{→}$C6H5Br+HBr;
(2)乙烯在催化剂条件下生成聚乙烯,化学方程式为: ,
,
故答案为: ;
;
(3)乙酸与CH3CH218OH发生酯化反应生成乙酸乙酯,方程式:CH3COOH+CH3CH218OH$→_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O,
故答案为:CH3COOH+CH3CH218OH$→_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O;
(4)乙烯的与Br2的加成反应生成1,2-二溴乙烷,方程式为:CH2=CH2+Br2$\stackrel{一定条件下}{→}$CH2Br-CH2Br;
故答案为:CH2=CH2+Br2$\stackrel{一定条件下}{→}$CH2Br-CH2Br.
点评 本题考查了有机化学方程式书写,为高频考点,把握物质的性质及发生的化学反应为解答的关键,注意酯化反应的原理及反应条件,题目难度不大.


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:解答题
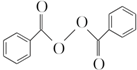 )过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图:
)过去常用作面粉增白剂,但目前已被禁用.合成过氧化苯甲酰的流程图如图: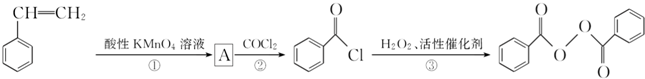
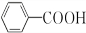 ;②的反应类型为取代反应.
;②的反应类型为取代反应.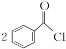 +H2O2$\stackrel{活性催化剂}{→}$
+H2O2$\stackrel{活性催化剂}{→}$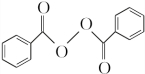 +2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为
+2HCl;过氧化苯甲酰在酸性条件下水解的化学方程式为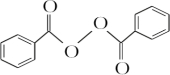 +2H2O$\stackrel{H+}{→}$
+2H2O$\stackrel{H+}{→}$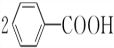 +H2O2.
+H2O2.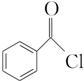 )能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯.
)能与水反应生成苯甲酸,同样也能与乙醇反应,写出其与乙醇反应生成的有机产物的名称:苯甲酸乙酯. (或
(或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
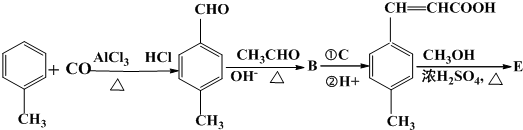
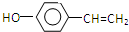 ;
;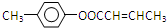 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为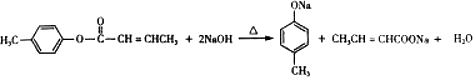 .
.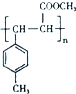 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子,回答下列问题:
周期表前四周期的元素a、b、c、d、e,原子序数依次增大,a的核外电子总数与其周期数相同,b的价电子层中的未成对电子有3个,c的最外电子数为其内层电子数的3倍,d与c同族;e的最外层只有1个电子,但次外层有18个电子,回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 晶体类型 | 原子晶体 | 离子晶体 | 分子晶体 |
| A. | 氮化硅 | 磷酸 | 单质硫 |
| B. | 单晶硅 | 碳酸氢铵 | 水银 |
| C. | 金刚石 | 烧碱 | 冰 |
| D. | 铁 | 尿素 | 冰醋酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg3N2+H2O═3Mg(OH)2+2NH3↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | 2NaOH+Cl2═NaCl+NaClO+H2O | D. | 2Na2O2+2CO2═2Na2CO3+O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com