
【题目】室温下向10mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A. 溶液中导电粒子的数目减少
B. 溶液中 不变
不变
C. 醋酸的电离程度增大,C(H+)亦增大
D. 再加入10mlpH=11的NaOH溶液,混合液pH=7
科目:高中化学 来源: 题型:
【题目】下列相关叙述正确的是( )
A.已知氢气和氯气在混合光照时发生爆炸,而氢气在氯气中点燃能安静燃烧,说明在同温同压下,H2(g) + Cl2(g) ═ 2HCl(g)反应条件不同,△H不同
B.将锌片直接放入足量稀硫酸中,另取同样的锌片与铜片用导线连接后再放入足量的稀硫酸中,充分反应后,两者放出的热量相同
C.NH4F溶液不能存放于玻璃试剂瓶中
D.某放热反应能自发进行,因此该反应是熵增反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5 mL 0.005 mol/L FeCl3溶液和5 mL 0.015 mol/L KSCN溶液混合,达到平衡后呈红色。再将混合液分为5份,分别进行如下实验:
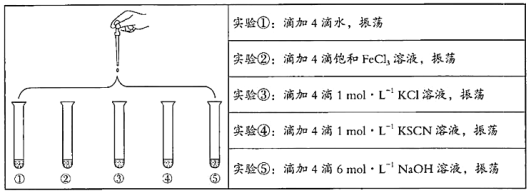
下列说法不正确的是
A. 对比实验①和②,为了证明增加反应物浓度,平衡发生正向移动
B. 对比实验①和③,为了证明增加反应物浓度,平衡发生逆向移动
C. 对比实验①和④,为了证明增加反应物浓度,平衡发生正向移动
D. 对比实验①和⑤,为了证明减少反应物浓度,平衡发生逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为_______________________。
(2)EAB2D4水溶液显酸性的原因是____________________________________。
(3)将等浓度等体积的EBC溶液和ABC溶液混合,所得混合溶液(呈碱性)中各微粒(水分子除外)浓度由大到小的顺序为_________________________________________。
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式__________________________________。
(5)常温下,测得X和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是_________。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2(g)![]() 2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将______移动(填“正向”、“逆向”或“不”)。
2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将______移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析化学中常用X射线研究晶体结构,有一种晶体可表示为[MxFey(CN)z],研究表明它的结构特性是Fe2+和Fe3+分别占据立方体的顶点,自身互不相邻,而CN-位于立方体的棱上,其晶体中的阴离子晶胞结构如图所示,下列说法正确的是( )
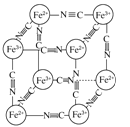
A.该晶体属于原子晶体
B.M的离子位于上述晶胞的面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将洁净的金属片甲、乙、丙、丁分别放置在浸有某种盐溶液的滤纸上面并压紧(如图所示)。
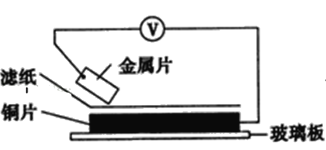
在每次实验时,记录电压指针的移动方向和电压表的读数如下表:(已知构成两电极的金属其金属活泼性相差越大,电压表的读数越大)依据记录数据判断,下列结论中正确的是( )
金属 | 电子流动方向 | 电压(V) |
甲 | 甲→Cu | +0.78 |
乙 | Cu→乙 | -0.15 |
丙 | 丙→Cu | +1.35 |
丁 | 丁→Cu | +0.30 |
A.金属乙能从硫酸铜溶液中置换出铜
B.甲、乙形成合金时,将该合金露置在空气中,甲先被腐蚀
C.在四种金属中乙的还原性最强
D.甲、丁若形成原电池时,甲为正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是有机化工原料和优质燃料,主要应用于精细化工、塑料等领域,也是农药、医药的重要原料之一。回答下列问题:
(1)工业上利用CO2和H2反应合成甲醇。已知25℃ 101kPa下:
H2(g)+![]() O2(g)═H2O(g) △H=﹣242kJmol﹣1
O2(g)═H2O(g) △H=﹣242kJmol﹣1
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
O2(g)=CO2(g)+2H2O(g)△H2=﹣676kJmol﹣1
①写出CO2和H2反应生成CH3OH(g)与H2O(g)的热化学方程式______
②下列表示该合成甲醇反应的能量变化示意图中正确的是______(填字母)
a. 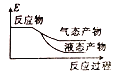 b.
b. 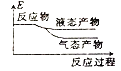 c.
c. 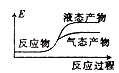 d.
d. 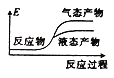
③合成甲醇所需的H2可由下列反应制取:H2O(g)+CO(g)H2(g)+CO2(g),某温度下该反应的平衡常数K=1,若起始时c(CO)=1molL﹣1,c(H2O)=2molL﹣1,则达到平衡时H2O的转化率为______
(2)CO和H2反应也能合成甲醇:CO(g)+2H2(g)CH3OH(g)△H=﹣90.1kJmol﹣1,在250℃下,将一定量的CO和H2投入10L的恒容密闭容器中,各物质浓度(molL﹣1)变化如下表所示(前6min没有改变条件)
2min | 4min | 6min | 8min | ||
CO | 0.07 | 0.06 | 0.06 | 0.05 | …… |
H2 | x | 0.12 | 0.12 | 0.2 | …… |
CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | …… |
①x=______,250℃时该反应的平衡常数K=______
②若6~8min时只改变了一个条件,则改变的条件是______,第8min时,该反应是否达到平衡状态?______(填“是”或“不是”)
③该合成反应的温度一般控制在240~270℃,选择此温度的原因是:
Ⅰ.此温度下的催化剂活性;
Ⅱ.______
(3)甲醇在催化剂条件下可以直接氧化成甲酸,在常温下,20.00mL 0.1000molL﹣1NaOH溶液与等体积、等浓度甲酸溶液混合后所得溶液的pH______(填“<”“>”或“=”)原因是______(用离子方程式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.(1)用系统命名法命名![]() ___;
___;
(2)相对分子质量为114,其一氯代物只有一种的链烃的结构简式___;
(3)某烃1分子含有50个电子,该烃只能由一种结构的炔烃加氢得到,则该烃的键线式为__。
Ⅱ.(1)将有机物B置于氧气流中充分燃烧,实验测得生成7.2gH2O和13.2gCO2,消耗氧气10.08L(标准状况),则该物质中各元素的原子个数之比是___。
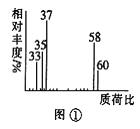
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为___,该物质的分子式是___。
(3)根据价键理论,预测A可能的结构简式:___(写出其中2种)。
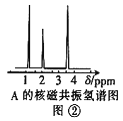
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值可以确定分子中氢原子的种类和数目。经测定,有机物A的核磁共振氢谱如图②,则A的结构简式为:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K、Ka、KW、Ksp分别表示化学平衡常数、弱酸的电离平衡常数、水的离子积常数、难溶电解质的溶度积常数。
(1)有关上述常数的说法正确的是__。
a.它们都能反映一定条件下对应变化进行的程度
b.它们的大小都随温度的升高而增大
c.常温下,CH3COOH在水中的Ka大于在饱和CH3COONa溶液中的Ka
(2)25℃时将amolL-1的氨水与0.01molL-1的盐酸等体积混合所得溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性;用含a的代数式表示NH3H2O的电离平衡常数Kb=__。
(3)已知25℃时CH3COOH和NH3.H2O电离常数相等,则该温度下CH3COONH4溶液中水电离的H+浓度为__,溶液中离子浓度大小关系为__。
(4)25℃时,H2SO3=HSO3-+H+的电离常数Ka=1×10-2molL-1,则该温度下pH=3、c(HSO3-)=0.1molL-1的NaHSO3溶液中c(H2SO3)=__。
(5)已知常温下Fe(OH)3和Mg(OH)2的Ksp分别为8.0×10-38、1.0×10-11,向浓度均为0.1mol/L的FeCl3、MgCl2的混合溶液中加入碱液,要使Fe3+完全沉淀而Mg2+不沉淀,应该调节溶液pH的范围是__。(已知lg2=0.3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com