
【题目】含硫煤燃烧会产生大气污染物,为防治该污染,某工厂设计了新的治污方法,同时可得到化工产品,该工艺流程如图所示,下列叙述不正确的是( )

A. 该过程中可得到化工产品H2SO4
B. 该过程中化合价发生改变的元素为Fe和S
C. 该工艺流程是除去煤燃烧时产生的SO2
D. 图中涉及的反应之一为Fe2(SO4)3+SO2 + 2H2O=2FeSO4+2H2SO4
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R皆为前20号元素,其原子半径与主要化合价的关系如图所示。下列说法错误是

A. Q位于第三周期IA族
B. X、Y、Z三种元素组成的化合物可能是盐或碱
C. 简单离子半径:M->Q+>R2+
D. Z与M的最高价氧化物对应水化物均为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是五种短周期元素。已知:它们的原子序数依次增大,A是元素周期表中原子半径最小的元素;B原子最外层电子数比其次外层电子数多2,C是E的邻族元素;D和E的原子序数之和为30,且D的族序数与周期数相等。甲、乙、丙、丁是它们两两形成的化合物,其中甲分子中含有18个电子。
物质组成 | 甲 | 乙 | 丙 | 丁 |
化合物中各元素 原子个数比 | A和C 1:1 | B和A 1:4 | D和E 1:3 | B和E 1:4 |
请回答下列问题:
(1)若元素E的某种核素中中子数比质子数多3个,表示这种核素的符号为____________;
(2)把D的单质放到NaOH溶液中,反应的离子方程式为:_______________________;
(3)用电子式表示甲的形成过程:_____________________________________________;
(4)在密闭容器中充入BC2、BC和乙的混合气体共mg,若加入足量Na2O2,并不断用电火花点燃至反应完全,测得固体质量增重mg,则BC2与乙的质量比为________________;
(5)有100mL MgCl2和丙的混合溶液,其中c(Mg2+)= 0.2 mol· L-1,c(Cl-)= 1.3mol·L-1,要使Mg2+全部转化为沉淀分离出来,至少需要4 mol·L-1 NaOH 溶液的体积是:____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的+1价离子X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。下列说法错误的是
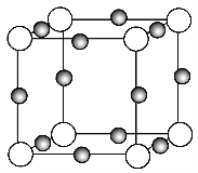
A. X元素的原子序数是19 B. X的晶体具有良好的导电性、导热性和延展性
C. X+离子是图中的黑球 D. 该晶体中阳离子与阴离子个数比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Murad等三位教授最早提出NO分子在人体内有独特功能,近年来此领域研究有很大进展,因此这三位教授获得了1998年诺贝尔医学奖及生理学奖。关于NO的下列叙述不正确的是( )
A. NO能够与人体血红蛋白结合,造成人体缺氧中毒
B. NO是汽车尾气的有害成分之一
C. NO在人体的血管系统内具有传送信号的功能
D. 常温下,N2和O2化合可得NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)湿法制各高铁酸钾(K2FeO4)的反应体系中有六种粒子:Fe(OH)3、ClO-、OH-、FeO42—、Cl-、H2O。
①写出并配平湿法制高铁酸钾反应的离子方程式:______________________________
②每生成l mol FeO42-转移__________mol电子,若反应过程中转移了0.3 mol电子,则还原产物的物质的量为____mol。
③低温下,在高铁酸钠溶液中加入KOH至饱和可析出高铁酸钾(K2FeO4)原因是__。
(2)工业上从海水中提取单质溴可采用如下方法:
①向海水中通入Cl2将海水中溴化物氧化,其离子方程式为____。
②向上述混合液中吹入热空气,将生成的溴吹出,用纯碱溶液吸收,其化学方程式为__。
③将②所得溶液用H2SO4酸化,使NaBr、NaBrO3中的溴转化为单质溴,再用有机溶剂提取溴后,还可得到副产品Na2SO4。这一过程可用化学方程式表示为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一瓶澄清的溶液,其中可能含有 H+、NH4+、Na+、Al3+、Fe3+、I-、NO3- 、CO32-、SO42- 、AlO2-。取该溶液进行以下实验:
①用pH试纸检验,溶液呈强酸性。
②取溶液适量,加入少量CCl4和数滴新制氯水,振荡,CCl4层呈紫红色。
③该溶液的焰色反应没有黄色;
④当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示。
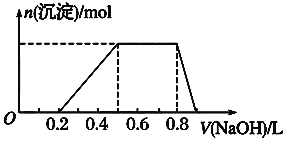
(1)该溶液中肯定含有的离子是_________________________,已确定阳离子的物质的量之比为_______________________。
(2)肯定不含的离子是_________________________________。
(3)不能确定的离子是_________,如何证明该离子是否存在?__________。
(4)请写出沉淀溶解过程的离子方程式____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质性质的变化规律,与共价键的键能大小有关的是( )
A. ![]() 、
、![]() 、
、![]() 、
、![]() 的熔点、沸点逐渐升高
的熔点、沸点逐渐升高
B. ![]() 的沸点高于
的沸点高于![]()
C. 金刚石的硬度、熔点、沸点都高于晶体硅
D. ![]() 、
、![]() 、
、![]() 、
、![]() 的熔点依次降低
的熔点依次降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒物质的量变化如下图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)。根据图示判断,下列说法正确的是( )

A. H2A在水中的电离方程式是:H2A===H++HA-、HA-![]() H++A2-
H++A2-
B. 等体积等浓度的NaOH溶液与H2A溶液混合后溶液显碱性
C. 当V(NaOH)=20 mL时,溶液中存在以下关系:c(H+)+c(H2A)=c(A2-)+c(OH-)
D. 当V(NaOH)=30 mL时,溶液中各粒子浓度的大小顺序为:c(Na+)>c(HA-)>c(A2-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com