



 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
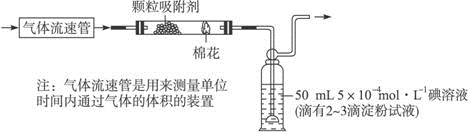
 实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.
实验室制取乙烯常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确证上述混合气体中含有乙烯和二氧化硫.查看答案和解析>>
科目:高中化学 来源: 题型:
| 稀硫酸 |
| △ |
| 一定条件 |
| 试剂X |
| NaOH溶液 |
| △ |
| [O] |
| H2O |
| [O] |
| [O] |
| KMnO4 |
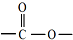 ,且无环状结构的同分异构体有
,且无环状结构的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
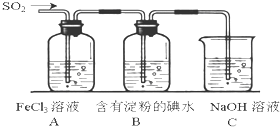 某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:
某校化学兴趣小组为探究SO2气体的还原性设计了如下装置图:查看答案和解析>>
科目:高中化学 来源: 题型:
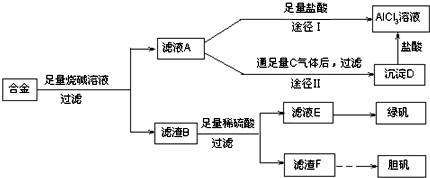
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
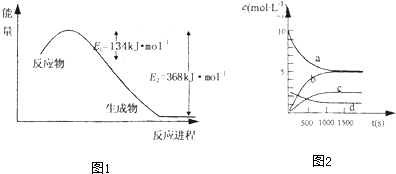 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少N的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com