
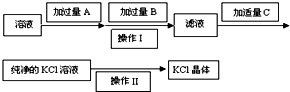
 为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2 溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:

科目:高中化学 来源: 题型:
 如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )| A、原子半径:R>Y>X |
| B、气态氢化物的稳定性:R<W |
| C、WX3和水反应形成的化合物具有挥发性 |
| D、Z的单质能和Y的最高价氧化物的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
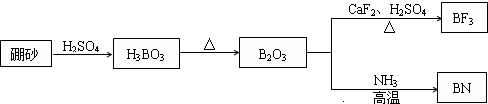
| Na2B2O7 | CaF2 | H3BO3 | NH3 | |
| A | 原子晶体 | 金属晶体 | 原子晶体 | 分子晶体 |
| B | 离子晶体 | 分子晶体 | 离子晶体 | 分子晶体 |
| C | 离子晶体 | 离子晶体 | 分子晶体 | 分子晶体 |
| D | 分子晶体 | 离子晶体 | 分子晶体 | 离子晶体 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
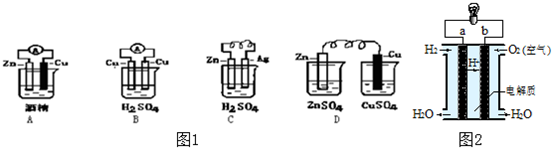
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验装置 | 实验现象 | 实验结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题:
1000℃时,硫酸钠可与氢气发生反应:Na2SO4(s)+4H2(g)?Na2S(s)+4H2O(g).请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 将反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,在图框中画出原电池的装置图,标出正、负极,并写出电极反应式.
将反应Cu+2FeCl3=CuCl2+2FeCl2设计成原电池,在图框中画出原电池的装置图,标出正、负极,并写出电极反应式.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com