(2013?开封模拟)某混合物X由Cu、SiO
2、Al
2O
3、Fe
2O
3中的一种或几种物质组成.进行如下实验.
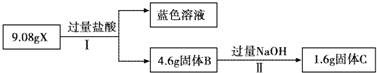
请回答下列问题:
(1)经Ⅰ得到蓝色溶液,该过程中一定发生的化学反应是(用离子方程式表示)
Fe2O3+6H+═2Fe3++3H2O
Fe2O3+6H+═2Fe3++3H2O
、
Cu+2Fe3+═2Fe2++Cu2+
Cu+2Fe3+═2Fe2++Cu2+
(2)X中一定含有的物质是
Cu、Fe2O3、SiO2
Cu、Fe2O3、SiO2
.反应Ⅱ的化学方程式是
SiO2+2NaOH═Na2SiO3+H2O
SiO2+2NaOH═Na2SiO3+H2O
.
(3)为进一步确定上述混合物X的成分,另取9.08g X进行如下实验.
①加入足量的NaOH溶液,过滤,将滤渣在氮气气流中干燥得固体mg.
②向滤渣中加入过量盐酸,过滤,将滤渣在氮气气流中干燥得固体ng.
上述①、②由于缺少
洗涤
洗涤
步骤(填操作名称),使得测定的质量m,n均
偏高
偏高
.
③按正确步骤重新进行实验后得到m=6.08g,n=1.6g.计算原混合物中各成分的质量之比是
m(Fe2O3):m(Cu):m(SiO2)=3.2:2.88:3.0
m(Fe2O3):m(Cu):m(SiO2)=3.2:2.88:3.0
.(不必化简)




 )中而形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )
)中而形成的,电池总反应方程式为:8Li+3SOCl2═6LiCl+Li2SO3+2S,下列叙述中正确的是( )