
【题目】2SO2(g)+O2(g)=2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3(g)的ΔH=-99kJ·mol-1。请回答下列问题:
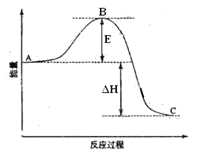
(1)图中A、C分别表示__________、______________,E的大小对该反应的反应热__________(填“有”或“无”)影响。该反应通常用V2O5作催化剂,加V2O5会使图中B点______(填“升高”或“降低”),△H_____(填“变大”、“变小”或“不变”)理由是________________;
(2)图中△H =_______kJ·mol-1;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物;四价钒化合物再被氧气氧化为V2O5。写出该催化循环机理的化学方程式_______________________________。
(4)已知单质硫的燃烧热为296KJ·mol-1,计算由S(s)生成3molSO3(g)的△H(写出计算过程):________。
【答案】反应物总能量 生成物总能量 无 降低 不变 因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热 -198 SO2+ V2O5=SO3+2VO2 4VO2+O2=2V2O5 解:根据题意可写成下列两个热化学方程式:S(s)+O2(g) =SO2(g) △H1=-296kJ/mol SO2(g)+l/2O2(g) =SO3(g) △H2=-99kJ/mol 根据盖斯定律得:S(s)+3/2O2(g)=SO3(g) △H3=-395kJ/mol △H=3△H3 = —1185 kJ/mol
【解析】
(1)因图中A、C分别表示反应物总能量、生成物总能量,B为活化能,反应热可表示为A、C活化能的大小之差,活化能的大小与反应热无关,催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热,故答案为:反应物总能量;生成物总能量;无;降低;不变;因为催化剂可以降低反应的活化能,但不能改变反应物的总能量和生成物的总能量之差,即不改变反应热;
(2)因1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1,图象中的能量变化是反应2SO2(g)+O2(g)2SO3(g)反应过程的能量变化;所以2molSO2(g)氧化为2molSO3的△H=-198kJmol-1,则2SO2(g)+O2(g)=2SO3(g)△H=-198KJmol-1,故答案为:-198;
(3)V2O5的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物反应的化学方程式为:SO2+V2O5=SO3+2VO2;四价钒化合物再被氧气氧化,依据化合价变化和氧化还原反应分析得到反应的化学方程式为:4VO2+O2=2V2O5,故答案为:SO2+V2O5=SO3+2VO2 4VO2+O2=2V2O5;
(4)单质硫的燃烧热为296kJmol-1,热化学方程式为:①S(s)+O2(g)=SO2(g)△H1=-296 kJmol-1,已知1mol SO2(g)氧化为1mol SO3的△H=-99kJmol-1.热化学方程式为:②SO2(g)+1/2O2(g) ![]() SO3(g)△H2=-99 kJmol-1 ;依据盖斯定律,②+①得到:③S(s)+O2(g)=SO3(g)△H=(△H1+△H2)kJ/mol;计算由S(s)生成3molSO3(g)③×3得到:3 S(s)+9/2O2(g)=3SO3(g)△H=3(△H1+△H2)=-1185 kJmol-1,故答案为:-1185 kJmol-1。
SO3(g)△H2=-99 kJmol-1 ;依据盖斯定律,②+①得到:③S(s)+O2(g)=SO3(g)△H=(△H1+△H2)kJ/mol;计算由S(s)生成3molSO3(g)③×3得到:3 S(s)+9/2O2(g)=3SO3(g)△H=3(△H1+△H2)=-1185 kJmol-1,故答案为:-1185 kJmol-1。


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量浓度的CuSO4和NaCl等体积混合后,用石墨电极进行电解,电解过程中,溶液pH随时间t变化的曲线如图(不考虑电极产物的溶解),则下列说法正确的是( )

A.阳极产物一定是Cl2,阴极产物一定是Cu
B.整个过程中阳极先产生Cl2,后产生O2
C.BC段表示在阴极上是H+放电产生了H2
D.CD段表示阳极上OH-放电破坏了水的电离平衡,产生了H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种盐,由A、B、C、D、E五种短周期元素元素组成。甲溶于水后可电离出三种离子,其中含有由A、B形成的10电子阳离子。A元素原子核内质子数比E的少1,D、E处于同主族。用甲进行如下实验:
①取少量甲的晶体溶于蒸馏水配成溶液;
③取少量甲溶液于试管中,向其中加入稀盐酸,再加入BaCl2溶液,出现白色沉淀;
③取少量甲溶液于试管中逐滴滴入NaOH溶液,生成沉淀的质量与滴入NaOH溶液的体积关系如下图所示,

④取少量甲溶液于试管中,加入过最的NaOH溶液并加热。
回答下列问题:
(1)C的元素符号是_______,D在周期表中的位置是________。
(2)经测定甲晶体的摩尔质量为453 gmol-1,其中阳离子和阴离子物质的量之比为1:1,则甲晶体的化学式为________。
(3)实验③中根据图象得V(oa):V(ab):V(bc)= _______。
(4)实验④中离子方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
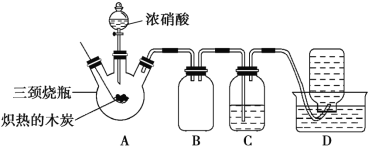
【题目】某化学学习小组采用下列装置,对浓硝酸与木炭的反应进行探究。
已知:4HNO3![]() 4NO2↑+O2↑+2H2O
4NO2↑+O2↑+2H2O
请回答下列问题:
(1)检查装置气密性后,将燃烧匙中的木炭在酒精灯上加热至红热状态,立即伸入三颈烧瓶中,并塞紧瓶塞,滴加浓硝酸,可观察到三颈烧瓶中气体的颜色为____,产生该气体的主要化学反应方程式是_____。
(2)装置C中盛有足量Ba(OH)2溶液,反应一段时间后可观察到C中出现白色沉淀,该白色沉淀为____(填化学式)。其中的Ba(OH)2溶液___(填“能”或“不能”)用Ca(OH)2溶液代替,理由是_____。
(3)装置B的作用是___。
(4)装置D中收集到了无色气体,部分同学认为是NO,还有部分同学认为是O2。
①下列对该气体的检验方法合适的是__(填序号)。
A.敞口观察集气瓶内气体的颜色变化
B.将润湿的蓝色石蕊试纸伸入集气瓶内,观察试纸是否变红
C.将带火星的木条伸入集气瓶中,观察木条是否复燃
②如果集气瓶中收集到的无色气体是氧气,则氧气的来源是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2是重要的化工原料,具有多种用途。
(1)Na2O2具有氧化性,可以将SO2氧化为硫酸钠,写出该反应的化学方程式:___,该反应中,Na2O2的作用为___(填“还原剂”、“氧化剂”或“既是氧化剂又是还原剂”)。
(2)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请选择适当的化学试剂和实验用品,用图中的实验装置进行实验,证明过氧化钠可作供氧剂。

装置A是CO2气体的发生装置,请写出仪器a的名称___,B中盛饱和NaHCO3溶液,其作用是___。写出C中过氧化钠与二氧化碳反应的化学方程式___。D中盛放的试剂可以是____(填序号)。
①浓H2SO4 ②NaOH溶液 ③CaCl2溶液 ④Na2SO3溶液
(3)将一定量的Na2O2固体投入到含有下列离子的溶液中:NO3-、HCO3-、CO32-、Na+,反应完毕后,溶液中上述离子数目几乎不变的有(不考虑溶液体积的变化)___(填离子符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置应用于铜与浓硫酸反应制取二氧化硫和硫酸铜晶体,能达到实验目的的是
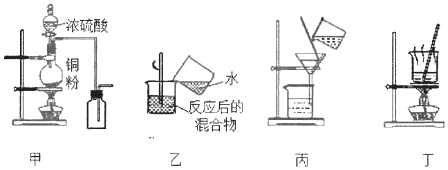
A. 用图甲装置制取并收集二氧化硫
B. 用图乙装置向反应后的混合物中加水稀释
C. 用图丙装置过滤出稀释后混合物中的不溶物
D. 用图丁装置将硫酸铜溶液蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于Na2CO3和 NaHCO3性质的说法正确的是( )
A.相同温度时,在水中的溶解度:NaHCO3>Na2CO3
B.与Ca(OH)2溶液反应:Na2CO3溶液中有白色沉淀生成,NaHCO3溶液中没有沉淀生成
C.热稳定性:NaHCO3>Na2CO3
D.相同物质的量浓度时,溶液的碱性:NaHCO3<Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:

(1)写出OA段所发生反应的离子方程式_____________、___________。
(2)当加入45mL盐酸时,产生CO2的体积为______________mL(标准状况)。
(3)写出碳酸钠溶液呈碱性的原因(用离子方程式表示)_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应mX(g)+nY(g)![]() qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的m/n倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 增加X的物质的量,Y的转化率降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com