


科目:高中化学 来源:不详 题型:单选题
| A.③②①⑤⑥⑦ | B.③①②⑥⑤ | C.④①⑥⑤⑦ | D.②①③⑥⑤⑦ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.0.40mol0.50mol0.12mol |
| B.0.66mol0.50mol0.24mol |
| C.0.64mol0.50mol0.24mol |
| D.0.64mol0.02mol0.24mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.测量一包固体的质量,将药品放在右盘,砝码放在左盘,并需移动游码使之平衡 |
| B.配制一定物质的量浓度的溶液,定容时俯视刻度线 |
| C.中和滴定用的锥形瓶加入待测液后,再加少量蒸馏水稀释 |
| D.用铜搅拌棒代替环形玻璃搅拌棒测量氢氧化钠和稀盐酸反应的中和热 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①② | B.②③ | C.①③ | D.①②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
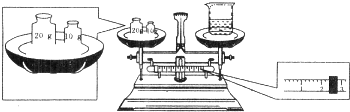
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com