
【题目】下表1是常温下几种弱酸的电离常数(K),表2是常温下几种难(微)溶物的溶度积常数(Ksp)。
表1几种弱酸的电离常数(25℃)
酸 | 电离常数(K) |
CH3COOH | 1.8×10-5 |
HNO2 | 5.1×10-4 |
HCN | 6.2×10-10 |
HClO | 3×10-8 |
表2几种难溶电解质的溶度积(25℃)
难(微)溶物 | 溶度积常数(Ksp) |
BaSO4 | 1.1×10-10 |
MgCO3 | 6.8×10-6 |
CaSO4 | 9.1×10-6 |
CaCO3 | 2.8×10-9 |
请回答下列问题:
(1)表1四种酸中,酸性最强的是____________(用化学式表示)。会使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是__________。
A.升高温度 B.加水稀释
C.加少量的CH3COONa固体 D.加少量冰醋酸
(2)常温下,相同物质的量浓度的表1中4种酸的钠盐pH由大到小的顺序是______________________________ (填钠盐的化学式)。若将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,溶液中各离子浓度由大到小的排列顺序是______________________________。
(3)①根据表2四种难(微)溶物的溶度积常数计算BaSO4的溶解度_______________(单位用g/L)表示,(已知![]() )。
)。
②在含有100mL0.2mol/L Ba2+、Ca2+、Mg2+的混合溶液中加入100mL0.1mol/LNa2SO/span>4溶液,反应后溶液中生成的沉淀是_________,此时SO42-的浓度是_________。
【答案】 HNO2 B NaCN>NaClO>CH3COONa>NaNO2 c(CH3COO-)>c(Na+)>c(H+)>c(OH-) 2.44×10-3g/L BaSO4 2.2×10-9mol/L
【解析】本题主要考查弱酸电离和关于溶度积的计算。
(1)表1四种酸中,酸性最强的是电离常数最大的HNO2。会使醋酸溶液中CH3COOH的电离程度增大,而电离常数不变的操作是B。A.平衡右移,电离常数增大;B.平衡右移,醋酸的电离程度增大,而平衡常数不变;C. c(CH3COO-)增大,平衡左移,醋酸的电离程度减小;D.醋酸浓度增大,醋酸的电离程度减小。故选B。
(2)酸性:HCN<HClO<CH3COOH<HNO2,所以水解程度:NaCN>NaClO>CH3COONa>NaNO2,相同物质的量浓度的4种酸的钠盐pH由大到小的顺序是NaCN>NaClO>CH3COONa>NaNO2。若将pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合,由于醋酸难电离,所以醋酸的浓度大于氢氧化钠,反应剩余大量醋酸而使溶液呈酸性,溶液中各离子浓度由大到小的排列顺序是c(CH3COO-)>c(Na+)>c(H+)>c(OH-)。
(3)①c(![]() )=
)=![]() mol/L=1.05×10-5mol/L,BaSO4的溶解度:1.05×10-5mol/L×233g/mol=2.44×10-3g/L。
mol/L=1.05×10-5mol/L,BaSO4的溶解度:1.05×10-5mol/L×233g/mol=2.44×10-3g/L。
②在含有100mL0.2mol/LBa2+、Ca2+、Mg2+的混合溶液中加入100mL0.1mol/LNa2SO4溶液,瞬间混合溶液中Ba2+、Ca2+、Mg2+的浓度为0.1mol/L,c(![]() )=0.05mol/L,Qc=0.005>Ksp(BaSO4)<Ksp(CaSO4),反应后溶液中生成的沉淀是BaSO4,此时c(Ba2+)=0.05mol/L,c(
)=0.05mol/L,Qc=0.005>Ksp(BaSO4)<Ksp(CaSO4),反应后溶液中生成的沉淀是BaSO4,此时c(Ba2+)=0.05mol/L,c(![]() )=
)= =2.2×10-9mol/L,Qc(CaSO4)= 2.2×10-8<Ksp(CaSO4),不会生成CaSO4。
=2.2×10-9mol/L,Qc(CaSO4)= 2.2×10-8<Ksp(CaSO4),不会生成CaSO4。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是
物质 | 杂质 | 试剂 | 主要操作 | |
A | NaHCO3 | Na2CO3 | ---- | 灼烧 |
B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
C | KBr溶液 | Br2 | KOH溶液 | 分液 |
D | Cl2 | HCl | 饱和碳酸钠溶液 | 洗气 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对盐类物质可有下列分类:如氯化硝酸钙[Ca(NO3)Cl]是一种混盐,硫酸铝钾KAl(SO4)2是一种复盐,冰晶石(六氟合铝酸钠)Na3AlF6是一种络盐。对于组成为CaOCl2的盐可归类于( )
A. 混盐 B. 复盐 C. 络盐 D. 无法归属于上述类别
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)丙烷是一种优良的燃料,下图是一定量丙烷完全燃烧生成CO2和1 mol H2O(l)过程中的能量变化图。试回答下列问题:

①写出表示丙烷燃烧热的热化学方程式:_________________________。
②二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1 mol二甲醚完全燃烧生成CO2和液态水放出1 455 kJ的热量。若1 mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1 645 kJ的热量,则混合气体中,丙烷和二甲醚的物质的量之比为_________________。
(2)盖斯定律认为:不管化学反应是一步完成或分步完成的,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
已知:H2O(g)H2O(l) ΔH1=-Q1kJ·mol-1
C2H5OH(g)C2H5OH(l) ΔH2=-Q2kJ·mol-1
C2H5OH(g)+3O2(g)2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1
若使23 g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g) ![]() 2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
2c(g)+D(g)在四种不同条件下的反应速率分别为( )。
①v(A)=0.5 mol/(L·min) ②v(B)=0.6 mol/(L·min)
③v(C)=0.35 mol/(L·min) ④v(D)=0.4 mol/(L·min)
则该反应在不同条件下反应速率最快的是( )
A.① B.② C.③ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图所示为锌铜原电池。下列叙述中,正确的是
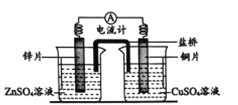
A. 盐桥的作用是传导离子
B. 外电路电子由铜片流向锌片
C. 锌片上的电极反应式为Zn2+ +2e- = Zn
D. 外电路中有0.2 mol 电子通过时,铜片表面增重约3.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+Cl2(g) ![]() 2HCl(g)反应的能量变化示意图如下:
2HCl(g)反应的能量变化示意图如下:

下列说法正确的是
A. 点燃条件和光照条件下,反应的ΔH不同
B. 反应的ΔH约为[2c- (a+b)]kJ·mol-1
C. “假想的中间物质”的总能量低于起始态H2和Cl2的总能量
D. 反应涉及的物质中,既有含极性键的物质,也有含非极性键的物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究铝片做电极材料时的原电池反应,设计下表中装置进行实验并记录。
【实验1】
装置 | 实验现象 |
| 左侧装置电流计指针向右偏转,灯泡亮 右侧装置电流计指针向右偏转,镁条、铝条表面产生无色气泡 |
(1)实验1中,电解质溶液为盐酸,镁条做原电池的________极。
【实验2】
将实验1中的电解质溶液换为NaOH溶液进行实验2。
(2)该小组同学认为,此时原电池的总反应为2Al + 2NaOH + 2H2O ![]() 2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
2NaAlO2 + 3H2↑,据此推测应该出现的实验现象为________。
实验2实际获得的现象如下:
装置 | 实验现象 |
| i.电流计指针迅速向右偏转,镁条表面无气泡,铝条表面有气泡 ⅱ.电流计指针逐渐向零刻度恢复,经零刻度后继续向左偏转。镁条表面开始时无明显现象,一段时间后有少量气泡逸出,铝条表面持续有气泡逸出 |
(3)i中铝条表面放电的物质是溶解在溶液中的O2,则该电极反应式为________。
(4)ii中“电流计指针逐渐向零刻度恢复”的原因是________。
【实验3和实验4】
为了排除Mg条的干扰,同学们重新设计装置并进行实验3和实验4,获得的实验现象如下:
编号 | 装置 | 实验现象 |
实验3 |
| 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约10分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
实验4 |
煮沸冷却后的溶液 | 电流计指针向左偏转。铝条表面有气泡逸出,铜片没有明显现象;约3分钟后,铜片表面有少量气泡产生,铝条表面气泡略有减少。 |
(5)根据实验3和实验4可获得的正确推论是________ (填字母序号)。
A. 上述两装置中,开始时铜片表面得电子的物质是O2
B. 铜片表面开始产生气泡的时间长短与溶液中溶解氧的多少有关
C. 铜片表面产生的气泡为H2
D. 由“铝条表面气泡略有减少”能推测H+在铜片表面得电子
(6)由实验1~实验4可推知,铝片做电极材料时的原电池反应与________等因素有关。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com