
【题目】氯气的化学性质很活泼,在一定条件下能与很多无机物和有机物反应,生成多种多样的含氯化合物。
(1)查阅文献:重铬酸钾与浓盐酸反应可以制备氯气。反应原理如下:K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O
请在上述反应中标出电子转移的方向和数目。__________________
(2)图1是某同学制备氯水的装置图。

①装置B中发生反应的离子方程式为__________________。
②检验一瓶氯水是否已经完全变质,可选用的试剂是______________(填序号)。
A.硝酸银溶液B.酚酞溶液 C.碳酸钠溶液 D.紫色石蕊溶液
(3)漂白粉或漂白精的有效成分为Ca(ClO)2,Ca(ClO)2能与空气中的CO2和水蒸气发生如下反应:Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO,分析以上反应,你认为存放漂白粉时应注意的问题有_________________________________________________。
(4)实验室欲用12 mol·L1的浓盐酸配制成250mL1.0 mol·L1的稀盐酸溶液。可供选择的仪器有:a.玻璃棒 b.烧瓶 c.烧杯 d.胶头滴管 e.量筒 f.托盘天平。
①上述仪器中,在配制稀盐酸溶液时不需要使用的有___________,还缺少的仪器是_____________。
②下列有关容量瓶的使用方法正确的是_____________(填代号)。
A.量筒量取浓盐酸试样后直接倒入容量瓶中,缓慢加水至接近刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线
B.配制一定体积、浓度的溶液时,容量瓶未干燥,对所配溶液浓度无影响
C.容量瓶用水洗净后,再用1.0 mol·L1的稀盐酸溶液润洗
D.使用容量瓶前检查它是否漏水
③根据计算,本实验需要量取浓盐酸的体积为______mL(计算结果保留一位小数)。
④对所配制的稀盐酸进行测定,发现浓度大于1.0mol/L。请你分析配制过程中可能引起浓度偏高的原因(答出两点)___________________、________________________。
【答案】 ![]() Cl2+2OH- = ClO-+Cl-+H2O D 密封保存,存放在阴凉干燥的地方,避免太阳直射 bf 250mL容量瓶 BD 20.8 定容时俯视容量瓶刻度线 【答题空10】浓盐酸稀释时未冷却就转移到容量瓶
Cl2+2OH- = ClO-+Cl-+H2O D 密封保存,存放在阴凉干燥的地方,避免太阳直射 bf 250mL容量瓶 BD 20.8 定容时俯视容量瓶刻度线 【答题空10】浓盐酸稀释时未冷却就转移到容量瓶
【解析】(1). 由反应方程式K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2↑+7H2O可知,Cr元素化合价变化情况为:K2Cr2O7→CrCl3,化合价由+6→+3价,两个Cr原子得6个电子;Cl元素的化合价变化情况为:HCl→Cl2,化合价由1价→0价,一个Cl原子失去一个电子,所以其最小公倍数为6,用双线桥表示为: ;
;
故答案为: ;
;
(2). ①.装置B中盛有NaOH,可以吸收多余的氯气,发生反应的离子方程式为:Cl2+2OH- = ClO-+Cl-+H2O,故答案为:Cl2+2OH- = ClO-+Cl-+H2O;
②. 检验一瓶氯水是否已经完全变质,主要是检查氯水中是否还含有HClO,HClO可以使石蕊试液褪色,A. 硝酸银溶液和氯离子反应生成白色沉淀,不能检验一瓶氯水是否已经完全变质,故A错误;B. 酚酞溶液在酸性溶液中不变色,故B错误;C. 碳酸钠溶液和盐酸反应生成二氧化碳气体,不能检验一瓶氯水是否已经完全变质,故C错误;D. 紫色石蕊试液遇酸显红色,不褪色说明完全变质,先变红后褪色证明没有完全变质,故D正确;答案选D;
(3). 漂白粉中的有效成分为Ca(ClO)2,容易和空气中的二氧化碳和水蒸气反应生成HClO,生成的HClO见光易分解,应密封保存,存放在阴凉干燥处,避免太阳直射,故答案为:密封保存,存放在阴凉干燥的地方,避免太阳直射;
(4). ①.实验室欲用12 mol·L1的浓盐酸配制成250mL1.0 mol·L1的稀盐酸溶液,需要量筒、烧杯、玻璃棒、250mL容量瓶、胶头滴管等,因此在配制稀盐酸溶液时不需要使用的有:烧瓶、托盘天平,还缺少的仪器是250mL容量瓶,故答案为:bf;250mL容量瓶;
②. A. 量筒量取浓盐酸试样后直接倒入烧杯中,加水溶解冷却后转移到容量瓶,缓慢加水至接近刻度线1-2cm处,用胶头滴管加蒸馏水至刻度线,不能直接在容量瓶中溶解,故A错误;B. 配制一定体积、浓度的溶液时,需要加水定容,容量瓶未干燥,对所配溶液浓度无影响,故B正确;C. 容量瓶用水洗净后,再用1.0 mol·L1的稀盐酸溶液润洗,溶质增多,配制的溶液浓度偏高,故C错误;D. 使用容量瓶之前必须检查是否漏水,故D正确;答案选BD;
③. 实验室欲用12 mol·L1的浓盐酸配制成250mL1.0 mol·L1的稀盐酸溶液,设需要量取浓盐酸的体积为amL,根据稀释定律有:a ×10-3L×12mol/L=0.25L×1.0mol/L,a=20.8mL,故答案为:20.8;
④ . 对所配制的稀盐酸进行测定,发现浓度大于1.0mol/L,配制过程中可能引起浓度偏高的原因有:定容时俯视容量瓶刻度线、浓盐酸稀释时未冷却就转移到容量瓶等,故答案为:定容时俯视容量瓶刻度线;浓盐酸稀释时未冷却就转移到容量瓶。


 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题: 
(1)制取乙炔的化学方程式为 .
(2)将制得的乙炔通入酸性KMnO4溶液中可观察溶液紫红色褪去,这是由于乙炔发生了反应.
(3)将制得的乙炔通入足量的溴的四氯化碳溶液,写出相关的化学方程式 .
(4)为了安全,乙炔气体在点燃前应 , 乙炔燃烧时的现象是 .
(5)验证电石与水反应生成的乙炔和溴发生加成反应,下列叙述正确的是 .
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯,常因温度过高而使乙醇和浓H2SO4生成少量的SO2 , 有人设计下列实验以确认上述混合气体中有乙烯和SO2 , 试回答下列问题: 
(1)图中①②③④装置可盛放的试剂是:
①;②;③;④
(将下列有关试剂的序号填入空格内).
A.品红溶液Β.ΝaΟΗ溶液C.浓硫酸△ D.酸性高锰酸钾溶液
(2)装置①中的现象是 .
(3)使用装置②的目的是 .
(4)使用装置③的目的是 .
(5)确证含有乙烯的现象是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,由CO2制备甲醇的过程可能涉及的反应如下:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH1=49.58 kJ·mol1
CH3OH(g)+H2O(g) ΔH1=49.58 kJ·mol1
反应Ⅱ:CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH2
CO(g)+H2O(g) ΔH2
反应Ⅲ:CO(g)+2H2(g) ![]() CH3OH(g) ΔH3=90.77 kJ·mol1
CH3OH(g) ΔH3=90.77 kJ·mol1
回答下列问题:
(1)反应Ⅱ的ΔH2=。
(2)反应Ⅲ能够自发进行的条件是(填“较低温度”、“较高温度”或“任何温度”)。
(3)恒温,恒容密闭容器中,对于反应Ⅰ,下列说法中能说明该反应达到化学平衡状态的是。
A.混合气体的密度不再变化
B.混合气体的平均相对分子质量不再变化
C.CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1∶1
D.甲醇的百分含量不再变化
(4)对于反应Ⅰ,不同温度对CO2的转化率及催化剂的效率影响如图所示,下列有关说法不正确的是______。
A.不同条件下反应,N点的速率最大
B.温度低于250 ℃时,随温度升高乙烯的产率增大
C.M点时平衡常数比N点时平衡常数大
D.实际反应应尽可能在较低的温度下进行,以提高CO2的转化率
(5)若在1 L密闭容器中充入 3mol H2 和1molCO2发生反应Ⅰ,则图中M点时,产物甲醇的体积分数为;该温度下,反应的平衡常数K=;若要进一步提高甲醇的体积分数,可采取的措施有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶铁的原料有铁矿石、焦炭、空气和石灰石。测得某冶铁高炉煤气的体积分数为CO-0.28;CO2-0.10; N2-0.58,棕色烟尘-0.04(不含氮元素)。若每生产1000kg生铁排放煤气2400 m3,则至少需要补充空气(空气体积分数:N2-0.8 、O2-0.2;气体都在同温同压下测定)
A.1392 m3B.1740 m3C.1920 m3D.2304 m3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( ) 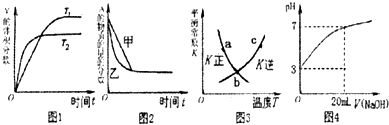
A.图1表示可逆反应“2X(g)Y(g)△H<0”温度T1<T2的情形
B.图2表示压强对可逆反应2A(g)+2B(g)3C(g)+D(s)的影响,乙的压强比甲的压强大
C.图3中a、b、c三点中只有b点已经达到化学平衡状态
D.图4是向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液过程中pH变化曲线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的量描述中不正确的是( )
A. 物质的量表示含有一定数目粒子的集合体
B. 物质的量的单位是摩尔
C. 0.012Kg12C中含有的碳原子的物质的量是1摩尔
D. 物质的量就是物质的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com