
【题目】下列氧化还原反应中,水只作为还原剂的是( )
A.3Fe+4H2O(g)![]() Fe3O4+4H2B.2H2O
Fe3O4+4H2B.2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
C.2Na2O2+2H2O═4NaOH+O2↑D.2F2+2H2O═4HF+O2
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下,物质①4gH2,②33.6LCH4,③1molH2O,④3.01×1023个O2.含分子数最多的是(填序号,下同)___,含原子数最少的是___,质量最大的是___,体积最小的是____。
(2)写出过氧化钠和水反应的化学方程式___
(3)在上述反应中,氧化剂是________,还原剂是______,每有1mol过氧化钠反应,则转移电子个数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华民族历史悠久,在浩瀚的历史文明中有许多关于化学的记载,下列说法不合理的是( )
选项 | 古代文献 | 记载内容 | 涉及原理 |
A | 《淮南万毕术》 | “曾青得铁则化为铜” | 活泼金属置换不活泼金属 |
B | 《鹤林玉露·一钱斩吏》 | “一日一钱,千日千钱,绳锯木断,水滴石穿” | 不涉及化学变化 |
C | 《天工开物》 | “凡火药,硫为纯阳,硝为纯阴” | 纯阴指化合价降低,利用硝酸钾的氧化性 |
D | 《肘后备急方》 | “青蒿一握,以水二升渍,绞取汁” | 利用物理方法提取青蒿素 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量的FeSO4、H2SO4和少量的Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁的工艺流程如图所示:

已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiO2+水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
回答下列问题:
(1)TiOSO4中钛元素的化合价是____________,步骤①中分离硫酸亚铁溶液和滤渣的操作是___________。
(2)滤渣的主要成分为TiO2·xH2O,结合离子方程式解释得到滤渣的原因:________。
(3)从硫酸亚铁溶液中得到硫酸亚铁晶体的操作方法是____________________;硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应的氧化剂和还原剂的物质的量之比为______。
(4)步骤④中发生反应的离子方程式为______________________。
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及____________________。
(6)实验室中检验溶液B中主要阳离子的方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y均为短周期元素,且![]() 比
比![]() 的电子层数多,下列说法正确的是( )
的电子层数多,下列说法正确的是( )
A.Y可能是第一周期元素
B.X和Y一定位于相邻的两个周期
C.a一定比b小
D.a+m+n-b的值一定为8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的。反应过程示意图如下:

下列说法正确的是
A. 过程Ⅰ、过程Ⅲ均为放热过程
B. 过程Ⅲ生成了具有极性共价键的H2、CO2
C. 使用催化剂降低了水煤气变换反应的ΔH
D. 图示过程中的H2O均参与了反应过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl |
溶解度/g (20 ℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之间的转化,实验操作如下:
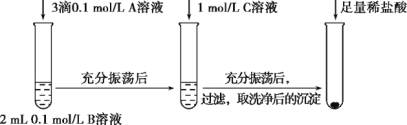
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
①实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,____。
②实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______。
③实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
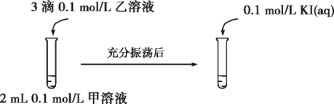
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表 读数 |
| ⅰ.如图连接装置并加入试剂,闭合K | a |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | |
ⅲ.再向B中投入一定量NaCl(s) | c | |
ⅳ.重复i,再向B中加入与ⅲ等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
①实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是____(填序号)。
a AgNO3溶液 b NaCl溶液 c KI溶液
②实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是_______。
③结合信息,解释实验Ⅳ中b<a的原因:_______。
④实验Ⅳ的现象能说明AgI转化为AgCl,理由是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂,硫酸镍晶体(NiSO4·7H2O)主要用于电镀工业。某小组用废镍催化剂(成分为Al2O3、Ni、Fe、SiO2、CaO等)制备草酸镍晶体的部分实验流程如下:
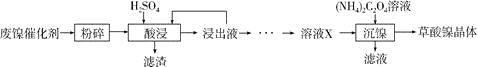
已知:①相关金属离子生成氢氧化物沉淀的pH如下表(开始沉淀的pH按金属离子浓度为1.0mol·L-1计算)。
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Al3+ | 3.0 | 5.0 |
Ni2+ | 6.7 | 9.5 |
②Ksp(CaF2)=1.46×10-10,Ksp(CaC2O4)=2.34×10-9。

(1)“粉碎”的目的是____________。
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如右图。“酸浸”的适宜温度与时间分别为_________(填字母)。
a.30℃、30min
b.90℃、150min
c.70℃、120min
d.90℃、120min
(3)证明“沉镍”工序中Ni2+已经沉淀完全的实验步骤及现象是___________。
(4)将“沉镍”工序得到的混合物过滤,所得固体用乙醇洗涤、110 ℃下烘干,得草酸镍晶体。
①用乙醇洗涤的目的是_________________。
②烘干温度不超过110℃的原因是_________________。
(5)由流程中的“浸出液”制备硫酸镍晶体的相关实验步骤如下:
第1步:取“浸出液”,___,充分反应后过滤,以除去铁、铝元素;
第2步:向所得滤液中加入适量NH4F溶液,充分反应后过滤,得“溶液X”;
第3步:___,充分反应后过滤;
第4步:滤渣用稍过量硫酸充分溶解后,蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得硫酸镍晶体。
①请补充完整相关实验步骤(可选试剂:H2SO4溶液、NaOH溶液、HNO3溶液、H2O2溶液)。
②第2步中加入适量NH4F溶液的作用是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铜银合金(含少量铁)废料为原料回收银和铜的工艺流程如下:

下列说法正确的是
A. 粗铜溶于过量稀硝酸,过滤、低温干燥得纯铜
B. 电解时用粗银作阴极,硝酸银溶液为电解质溶液
C. 用稀硫酸处理渣料时主要发生了氧化还原反应
D. 从滤液B中可以提取绿矾(FeSO4·7H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com