
【题目】如图所示为实验室模拟工业上催化裂化的装置示意图,根据图示回答下列问题。
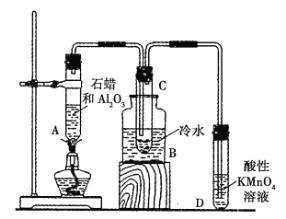
(1)工业上石油裂化的主要目的是_______________________。
(2)A中氧化铝的作用是_____________,B中冷水的作用是___________________。
(3)C中得到的液体具有汽油的气味,该液体________________(填“能”或“不能”,下同)通过化学反应使溴水褪色,而通过石油分馏得到的汽油_______________通过化学反应使溴水褪色。
(4)D中酸性高锰酸钾溶液褪色,说明石蜡裂化时除有液态不饱和烃生成外,还有__________生成。
 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:
【题目】某温度下,![]() 和
和![]() 的电离常数分别为
的电离常数分别为![]() 和
和![]() 。将
。将![]() 和体积均相同的两种酸溶液分别稀释,其
和体积均相同的两种酸溶液分别稀释,其![]() 随加水体积的变化如图所示。下列叙述正确的是( )
随加水体积的变化如图所示。下列叙述正确的是( )
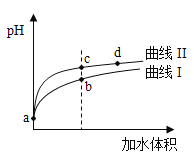
A. 曲线Ⅰ代表![]() 溶液
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中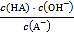 保持不变(其中
保持不变(其中![]() 、
、![]() 分别代表相应的酸和酸根离子)
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与![]() 恰好中和后,溶液中
恰好中和后,溶液中![]() 相同
相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在某杂志上发表研究报告称,利用铬同位素的系统分析发现,“古代大气氧含量高于现代水平的1%”。铬的同位素有![]() 、
、![]() 、
、![]() 、
、![]() 。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
。铬及其化合物在生活、生产中有广泛应用。回答下列问题:
(1)基态![]() 的价层电子排布图为_________
的价层电子排布图为_________
(2)交警用“酒精仪”查酒驾,其化学反应原理如下:
2K2Cr2O7+3CH3CH2OH+8H2SO4→3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O
①CH3CH2OH、CH3COOH的沸点高于对应的CH3OCH3(二甲醚)、HCOOCH3(甲酸甲酯),其主要原因是___________。
②CH3COOH分子中碳原子的杂化类型是______;CH3COOH分子中σ键和π键数目之比为_________。
③K2SO4晶体中阴离子的空间构型是________。上述反应中,只含极性键的极性分子有________(填分子式)。
(3)晶体铬的晶胞结构如图1所示,其堆积模型为___________;铬原子的配位数为___________。

(4)铬的一种氧化物晶胞结构如图2所示。六棱柱边长为a nm,高为b nm,NA代表阿伏加德罗常数的值。该晶体的化学式为______;该晶体的密度ρ=_______g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛呈银白色,因它坚硬、强度大、耐热、密度小,被称为高技术金属。目前生产钛采用氯化法,主要步骤如下:
Ⅰ.即将金红石或钛铁矿与焦炭混合,通入氯气并加热制得TiCl4:
2FeTiO3+7Cl2+6C![]() 2TiCl4+2FeCl3+6CO
2TiCl4+2FeCl3+6CO
TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
Ⅱ.将TiCl4蒸馏并提纯,在氩气保护下与镁共热得到钛:
TiCl4+2Mg![]() Ti+2MgCl2
Ti+2MgCl2
Ⅲ.用稀盐酸溶解MgCl2和过量Mg后得海绵状钛,再在真空熔化铸成钛锭。
请回答下列问题:
(1)基态钛原子的价电子排布式为___。
(2)与CO互为等电子体的离子为___(填化学式)。
(3)在CH2Cl2、HCHO、CO2、C2H4中,碳原子采取sp2杂化的分子有___。
(4)TiCl4在常温下是无色液体,在水或潮湿空气中易水解而冒白烟。则TiCl4属于___(填“原子”“分子”或“离子”)晶体。
(5)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是___;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为___。
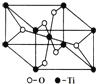
(6)在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如图所示,则其中Ti4+的配位数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A.分子的中心原子通过sp3杂化轨道成键时,该分子一定为正四面体结构
B.1,2-二氯丙烷(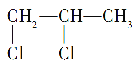 )分子中含有两个手性碳原子
)分子中含有两个手性碳原子
C.熔、沸点:Na<Mg<Al
D.配合物的稳定性与配位键的强弱有关,与配位体的性质无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1的NaOH溶液分别滴定20.00mL均为0.1000mol·L-1的三种酸HX、HY、HZ ,滴定曲线如图所示。下列说法错误的是
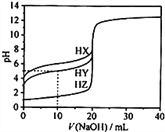
A. HZ是强酸,HX、HY是弱酸
B. 根据滴定曲线,可得Ka(HY)≈10-5
C. 将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X-)>c(Y-)>c(OH-)>c(H+)
D. 将上述HY与HZ溶液等体积混合达到平衡时:C(H+)=c(OH-)+c(Z-)+c(Y-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是地壳中含量较丰富的元素,仅次于氧、硅、铝元素,其单质及合金是在生产生活中应用广泛的金属材料。化学上常用KSCN溶液等来检验溶液中是否存在Fe3+。
(1)Fe3+离子基态的电子排布式可表示为___。
(2)一种铁晶体的晶胞属于体心立方堆积,则该晶胞中所包括的铁原子的个数是___。
(3)C、N两种元素的简单气态氢化物的热稳定性由强到弱的顺序为___。(填化学式)
(4)C、N、O三种元素的第一电离能由大到小的顺序为___(填元素符号)。
(5)离子化合物Fe2O3的熔点高于KC1的熔点的原因是___。
(6)据报道:由Q、X、Z三种元素形成的一种晶体具有超导性,其晶体结构如图所示。晶体中距每个X原子周围距离最近的Q的原子的个数是___。
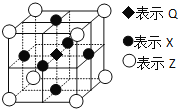
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 时,将浓度均为
时,将浓度均为![]() 、体积分别为
、体积分别为![]() 和
和![]() 的
的![]() 溶液与
溶液与![]() 溶液按不同体积比混合,保持
溶液按不同体积比混合,保持![]() ,
,![]() 、
、![]() 与混合液的
与混合液的![]() 的关系如图所示,下列说法不正确的是( )
的关系如图所示,下列说法不正确的是( )
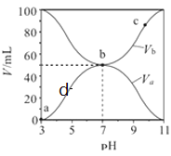
A.![]() 的数量级约为
的数量级约为![]()
B.b点时![]()
C.a、b、d几点中,水的电离程度![]()
D.![]() 点过程中,可能存在
点过程中,可能存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。
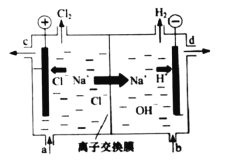
完成下列填空:
(1)写出电解饱和食盐水的离子方程式_______。
(2)离子交换膜的作用为:______、______。
(3)精制饱和食盐水从图中_____位置补充,氢氧化钠溶液从图中_____位置流出(选填“a”、“b”、“c”或“d”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com