
分析 (1)可逆反应达到平衡状态时,正逆反应速率相等,各物质的物质的量、物质的量浓度、百分含量及由此引起的一系列物理量不变;
(2)同一可逆反应同一时间段内各物质的反应速率之比等于计量数之比,据此计算二氧化氮反应速率,再根据n=vtV计算二氧化氮物质的量;
(3)该反应是一个反应前后气体计量数之和不变的放热反应,升高温度、加入催化剂、增大压强都增大反应速率;
(4)若上述容器为绝热容器(与外界无热交换),该反应的正反应是放热反应,所以相当于升高温度,反应速率加快.
解答 解:(1)a.该反应是一个反应前后气体计量数之和不变的可逆反应,所以压强始终不变,所以体系压强保持不变不能说明该反应达到平衡状态,故错误;
b.混合气体颜色保持不变,说明各物质浓度不变,所以该反应达到平衡状态,故正确;
c.SO3和NO的体积比保持不变时该反应可能达到平衡状态也可能没有达到平衡状态,与反应物初始浓度及转化率有关,所以不能据此判断平衡状态,故错误;
d.无论该反应是否达到平衡状态,都存在每消耗n mol SO3的同时生成n mol NO2,所以不能据此判断平衡状态,故错误;
故选b;
(2)同一可逆反应同一时间段内各物质的反应速率之比等于计量数之比,v(NO2)=v(NO)=0.005mol•L-1•s-1,则参加反应的n(NO)=vtV=0.005mol•L-1•s-1×20s×2L=0.2mol,
故答案为:0.2;
(3)该反应是一个反应前后气体计量数之和不变的放热反应,升高温度、加入催化剂、增大压强都增大反应速率,降低温度反应速率降低,故选bc;
(4)若上述容器为绝热容器(与外界无热交换),该反应的正反应是放热反应,所以相当于升高温度,反应速率加快,则缩短反应达到平衡时间,故选b.
点评 本题考查化学平衡状态判断、反应速率有关计算、化学平衡影响因素、反应速率影响因素等知识点,侧重考查学生分析判断能力,注意:只有反应前后改变的物理量才能作为平衡状态判断依据,易错点是(4)题,相当于升高温度.


科目:高中化学 来源: 题型:选择题
| A. | M原子所含质子数一定大于R原子所含质子数 | |
| B. | M、R两种元素结合形成的化合物中不可能含有共价键 | |
| C. | M2-与R+的电子层结构不可能相同 | |
| D. | M一定存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 外围电子分别是1s2与2s2的元素 | |
| B. | M层上有两个电子与N层上有两个电子的元素 | |
| C. | 2p上有一个未成对电子与3p上有一个未成对电子的元素 | |
| D. | L层上有一个空轨道和M层的p轨道上有一个空轨道的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向铁粉中加入足量稀硝酸:2Fe+6H+═2Fe3++3H2↑ | |
| B. | NO2溶于水:3NO2+H2O═2H++2NO3-+NO | |
| C. | 氢氧化铜与稀硝酸反应:H++OH-═H2O | |
| D. | 向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-═AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
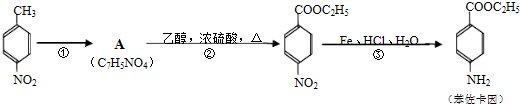
 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
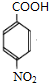
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$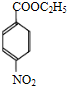 +H2O;
+H2O;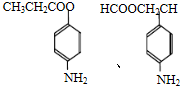 ,则剩余三种同分异构体的结构简式为:
,则剩余三种同分异构体的结构简式为: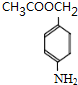 、
、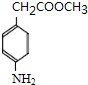 、
、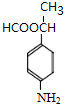 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是烃类化合物 | B. | 常温下呈固态 | ||
| C. | 具有类似金刚石的硬度 | D. | 分子中最多可能有281个碳碳叁键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com