
 ,符合这一条件的烯烃有( )
,符合这一条件的烯烃有( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 加成反应指有机物分子中的不饱和键断裂,断键原子与其他原子或原子团相结合,生成新的化合物的反应.
先判断该烃结构是否对称,如果对称,只考虑该分子一边的结构和对称线两边相邻碳原子即可;如果不对称,要全部考虑,然后各去掉相邻碳原子上的一个氢原子形成双键.
解答 解:根据烯烃与H2加成反应的原理,推知该烷烃分子中相邻碳原子上均带氢原子的碳原子间是对应烯烃存在碳碳双键的位置,因此相应烯烃分子中存在碳碳双键的位置有3种,结构简式为:CH2=CH(CH3)CH(CH3)C(CH3)3、(CH3)2C=C(CH3)C(CH3)3、(CH3)2CH(C=CH2)C(CH3)3;
故选C.
点评 本题以加成反应为载体,考查同分异构体的书写,理解加成反应原理是解题的关键,采取逆推法还原C=C双键,注意分析分子结构是否对称,防止重写、漏写.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | H2在正极发生氧化反应 | |
| B. | 供电时的总反应是 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | |
| C. | 氢氧燃料电池中反应放出的热量转变为电能 | |
| D. | 电解质溶液中OH-向负极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是化肥工业和基础化工的重要原料.请回答下列问题:
氨是化肥工业和基础化工的重要原料.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
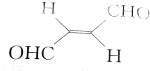 ,下列叙述正确的有( )
,下列叙述正确的有( )| A. | 分子间可形成氢键 | B. | 分子中既有极性键又有非极性键 | ||
| C. | 分子中有7个σ键和1个π键 | D. | C原子的杂化方式是sp2和sp3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;
;25℃、101kPa时该气态氢化物热值为5×104kJ•kg-1,则其标准燃烧热为-1300kJ/mol;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF比H2O稳定 | |
| D. | HF、HCl、HBr、HI的稳定性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃101 kPa时,2C(s)+O2(g)═2CO(g)△H=-221 kJ•mol-1此反应的反应热为221 kJ•mol-1 | |
| B. | 氢气的燃烧热为285.8 kJ•mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ•mol-1 | |
| C. | 已知2SO2(g)+O2(g)═2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量 | |
| D. | 稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1稀硝酸与稀Ba(OH)2溶液反应的中和热为57.3 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com