
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)①把含有较高浓度CO2的空气通入饱和K2CO3溶液。②在①的吸收液中通高温水蒸气得到高浓度的CO2气体。写出②中反应的化学方程式__________________________。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是 (填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
②适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入 2
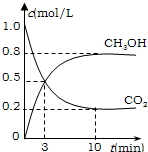
mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
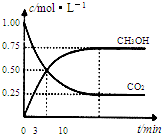
△H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
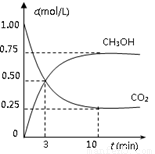
从反应开始到平衡,v(H2)= ;氢气的转化率= ;能使平衡体系中n(CH3OH)增大的措施有__________________________________________________。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。已知:
CH4 (g) +2O2(g)=CO2(g)+2H2O(l) △H1=―890.3 kJ/mol
H2(g) + 1/2O2(g)=H2O(l) △H2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是____________________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
|
溶解度(S)/g |
溶度积(Ksp) |
||
|
Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
|
0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是 (填“Ca(OH)2”或“Ba(OH)2”)溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定 。
(16分)
(1)② 2KHCO3 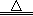 K2CO3+H2O+CO2↑
(2分)
K2CO3+H2O+CO2↑
(2分)
(2)① B(2分)
② v(H2)=0.225 mol/(L·min) 75% 降低温度(或加压或增大H2的量等)(各2分)
(3)CO2(g) + 4H2(g)=CH4 (g) + 2H2O(l) △H=—252.9 kJ/mol (2分)
(4)Ba(OH)2 BaCO3的质量 (4分,各2分)
【解析】
试题分析:(1)依题意,饱和碳酸钾溶液吸收二氧化碳可用于制取碳酸氢钾,碳酸氢钾不稳定,受热易分解,生成碳酸钾、二氧化碳气体和水,即反应①②分别是K2CO3+H2O+CO2=2KHCO3、2KHCO3 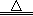 K2CO3+H2O+CO2↑;(2)①依题意,设烃分子式为CxHy,根据系数之比等于物质的量之比和质量守恒定律,则CO2+3H2→CxHy+2H2O,根据碳、氢、氧原子个数守恒,则x=1、y=2,则生成的烃中碳、氢原子个数之比为1∶2,只有烯烃(CnH2n)符合题意,故B正确;②读图,达到平衡的时间为10min,由于氢气的起始浓度、平衡浓度未知,不能直接求氢气表示的平均反应速率,但是图中二氧化碳的起始浓度、平衡浓度已知,能直接求二氧化碳表示的平均反应速率,二氧化碳的起始浓度、平衡浓度分别为1.00 mol·L-1、0.25 mol·L-1,则10min内二氧化碳的平均反应速率=
K2CO3+H2O+CO2↑;(2)①依题意,设烃分子式为CxHy,根据系数之比等于物质的量之比和质量守恒定律,则CO2+3H2→CxHy+2H2O,根据碳、氢、氧原子个数守恒,则x=1、y=2,则生成的烃中碳、氢原子个数之比为1∶2,只有烯烃(CnH2n)符合题意,故B正确;②读图,达到平衡的时间为10min,由于氢气的起始浓度、平衡浓度未知,不能直接求氢气表示的平均反应速率,但是图中二氧化碳的起始浓度、平衡浓度已知,能直接求二氧化碳表示的平均反应速率,二氧化碳的起始浓度、平衡浓度分别为1.00 mol·L-1、0.25 mol·L-1,则10min内二氧化碳的平均反应速率=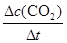 =
=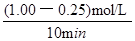 =7.5×10-2mol/(L•min);由于CO2(g)+3H2(g)
=7.5×10-2mol/(L•min);由于CO2(g)+3H2(g)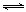 CH3OH(g)+H2O(g)中各物质表示的平均反应速率之比等于系数之比,则v(H2)/v(CO2)=3/1,所以v(H2)=
3×7.5×10-2mol/(L•min)= 0.225mol/(L•min);依题意,可以推断反应体系各组分的(起始、变化、平衡)浓度,则:
CH3OH(g)+H2O(g)中各物质表示的平均反应速率之比等于系数之比,则v(H2)/v(CO2)=3/1,所以v(H2)=
3×7.5×10-2mol/(L•min)= 0.225mol/(L•min);依题意,可以推断反应体系各组分的(起始、变化、平衡)浓度,则:
CO2(g)+3H2(g)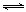 CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度/ mol·L-1 1.00 3.00 0 0
变化浓度/ mol·L-1 0.75 2.25 0.75 0.75
平衡浓度/ mol·L-1 0.25 0.75 0.75 0.75
氢气的平衡转化率=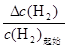 ×100%=
×100%=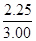 ×100%=75%
×100%=75%
由于正反应是气体体积减小的放热反应,根据化学平衡移动原理,增大二氧化碳或氢气的浓度、减小水蒸气的浓度、缩小容器容积增大压强、降低温度,都能使平衡右移,增大平衡体系中甲醇的物质的量;(2)先将已知反应编号为①②,②×2—①可得未知的热化学方程式,根据盖斯定律可以求得焓变,即:CO2(g) + 4H2(g)=CH4
(g) + 2H2O(l) △H=—252.9 kJ/mol;(4)依题意,20℃时氢氧化钙的溶解度小于氢氧化钡,则0.16g氢氧化钙溶于100g水形成饱和氢氧化钙溶液,由于c=n/V=m/(M•V),稀溶液的体积约等于水的体积,则饱和氢氧化钙溶液的物质的量浓度约为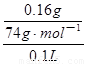 =0.022mol/L,同理可得,饱和氢氧化钡溶液的物质的量浓度约为
=0.022mol/L,同理可得,饱和氢氧化钡溶液的物质的量浓度约为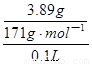 =0.23mol/L,则氢氧化钙饱和溶液的浓度小于饱和氢氧化钡溶液,前者吸收二氧化碳的能力小于后者;Ksp(CaCO3)>Ksp(BaCO3),则在溶液中BaCO3比CaCO3容易沉淀完全,所以应选择氢氧化钡溶液吸收二氧化碳气体;过量的氢氧化钡吸收一定体积的工业废气时,发生反应为:Ba(OH)2+CO2=BaCO3↓+H2O,根据各物质的物质的量之比等于系数之比,通过测量BaCO3沉淀的质量,可以计算出二氧化碳的体积,二氧化碳的体积除以废气的总体积,就能计算废气中二氧化碳的体积分数。
=0.23mol/L,则氢氧化钙饱和溶液的浓度小于饱和氢氧化钡溶液,前者吸收二氧化碳的能力小于后者;Ksp(CaCO3)>Ksp(BaCO3),则在溶液中BaCO3比CaCO3容易沉淀完全,所以应选择氢氧化钡溶液吸收二氧化碳气体;过量的氢氧化钡吸收一定体积的工业废气时,发生反应为:Ba(OH)2+CO2=BaCO3↓+H2O,根据各物质的物质的量之比等于系数之比,通过测量BaCO3沉淀的质量,可以计算出二氧化碳的体积,二氧化碳的体积除以废气的总体积,就能计算废气中二氧化碳的体积分数。
考点:考查化学反应原理,涉及碳酸氢盐受热分解的化学方程式、质量守恒定律、烃的分子通式、反应物和生成物的浓度—时间图像、平均反应速率的计算、反应物平衡转化率的计算、外界条件对平衡移动的影响、盖斯定律、热化学方程式、溶解度、物质的量浓度、溶度积、物质的量在化学方程式计算中的应用、质量、摩尔质量、气体摩尔体积、体积、体积分数等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
 (2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
(2013?红桥区二模)为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
| ||
| ||
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究.| 1 |
| 2 |
| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1.下列叙述中不正确的是( )
为减小CO2对环境的影响,在倡导“低碳”的同时,还需加强对CO2创新利用的研究.已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ/mol.T1℃时,向体积为1L的恒容密闭容器中充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示,且平衡时体系压强为P1.下列叙述中不正确的是( )| A、0~3min内,v(CO2)正=v (CH3OH)正 | B、其他条件不变,若向平衡后的体系中充入1mol氦气,体系压强增大平衡将向正方向移动 | C、在T1℃时,若起始时向容器中充入2molCO2和6mol H2,测得平衡时容器内压强为P2,则 P2<2P1 | D、T2℃时,上述反应平衡常数为4.2,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源:2012届杭师大附中普通高校招生适应性考试理综试卷(化学部分) 题型:填空题
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式________。
(2)如将CO2与H2以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是_______(填序号)。
| A.烷烃 | B.烯烃 | C.炔烃 | D.苯的同系物 |
 CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。
 CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol
CO2(g)+ 2H2O(l) ΔH1=― 890.3 kJ/mol H2O(l) ΔH2=-285.8 kJ/mol
H2O(l) ΔH2=-285.8 kJ/mol| 溶解度(S)/g | 溶度积(Ksp) | ||
| Ca(OH)2 | Ba(OH)2 | CaCO3 | BaCO3 |
| 0.16 | 3.89 | 2.9×10-9 | 2.6×10-9 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年杭师大附中普通高校招生适应性考试理综试卷(化学部分) 题型:综合题
为减小CO2对环境的影响,在限制其排放量的同时,应加强对CO2创新利用的研究。
(1)① 把含有较高浓度CO2的空气通入饱和K2CO3溶液。
② 在①的吸收液中通高温水蒸气得到高浓度的CO2气体。
写出②中反应的化学方程式________。
(2)如将CO2与H2 以1:3的体积比混合。
①适当条件下合成某烃和水,该烃是_______(填序号)。
A.烷烃 B.烯烃 C.炔烃 D.苯的同系物
② 适当条件下合成燃料甲醇和水。在体积为2L的密闭容器中,充入2 mol CO2和6 mol H2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。
CH3OH(g)+H2O(g)
△H=-49.0 kJ/mol。
测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
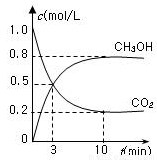
从反应开始到平衡,v(H2)=______;氢气的转化率=_______;能使平衡体系中n(CH3OH)增大的措施有______。
(3)如将CO2与H2 以1:4的体积比混合,在适当的条件下可制得CH4。
已知:
CH4 (g) + 2O2(g)  CO2(g)+
2H2O(l) ΔH1=― 890.3 kJ/mol
CO2(g)+
2H2O(l) ΔH1=― 890.3 kJ/mol
H2(g) + 1/2O2(g)  H2O(l)
ΔH2=-285.8 kJ/mol
H2O(l)
ΔH2=-285.8 kJ/mol
则CO2(g)与H2(g)反应生成CH4(g)与液态水的热化学方程式是________。
(4)某同学用沉淀法测定含有较高浓度CO2的空气中CO2的含量,经查得一些物质在20℃的数据如下表。
|
溶解度(S)/g |
溶度积(Ksp) |
||
|
Ca(OH)2 |
Ba(OH)2 |
CaCO3 |
BaCO3 |
|
0.16 |
3.89 |
2.9×10-9 |
2.6×10-9 |
(说明:Ksp越小,表示该物质在水溶液中越易沉淀)
吸收CO2最合适的试剂是_________[填“Ca(OH)2”或“Ba(OH)2”]溶液,实验时除需要测定工业废气的体积(折算成标准状况)外,还需要测定__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com