
| 实 验 内 容 | 实 验 方 法 | 实 验 现 象 |
| 验证氧化性 | ||
| 验证不稳定性 |
| 5mol×0.001cVmol |
| 2mol×0.025mol |
| 1.7cVg |
| 10ρg |
| 17cV |
| ρ |
| 17cV |
| ρ |
| 实验内容 | 实验方法 | 实验现象 |
| 验证氧化性 | 取适量饱和硫化氢溶液于试管中,滴入 过氧化氢溶液.(或取适量碘化钾淀粉溶液于试管中,加入过氧化氢溶液.) | 产生淡黄色沉淀或溶液变浑浊.(或溶液变蓝色.) |
| 验证不稳定性 | 取适量过氧化氢溶液于试管中,加热, 用带火星的木条检验.(或取适量过氧化氢溶液于试管中,加热,用导气管将得到的气体通入到装有饱和硫化氢溶液的试管中.) | 产生气泡,木条复燃. (或溶液变浑浊或有浅黄色沉淀产生) |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | K+ Na+ Cu2+ Al3+ |
| 阴离子 | SO42- HCO3- NO3- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、气态氢化物的稳定性:HnX 强于HmY |
| B、X和Y形成化合物时,X显负价,Y显正价 |
| C、第一电离能一定是:Y小于X |
| D、最高价含氧酸的酸性:X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
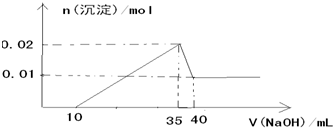
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢化物受热易分解 |
| B、最高价氧化物对应的水化物是一种强酸 |
| C、其单质既有氧化性又有还原性 |
| D、是生物生长所需的一种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫原子的2p轨道和氢原子的1s轨道 |
| B、硫原子的2p轨道和氢原子的2p轨道 |
| C、硫原子的3p轨道和氢原子的1s轨道 |
| D、硫原子的2p轨道和氢原子的3p轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲另用了酚酞试液 |
| B、乙另用了NaOH溶液 |
| C、丙另用了石蕊试液 |
| D、丁不另用任何试剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com