
| A. | C的体积分数增大 | B. | 平衡向右移动 | C. | B的转化率提高 | D. | a+b<c+d |
分析 保持温度不变,将容器的体积缩小1倍,如果平衡不移动,C气体的浓度为1mol/L,实际C的浓度变为0.9mol/L,说明平衡向逆反应方向移动,据此结合选项解答.
解答 解:保持温度不变,将容器的体积缩小1倍,如平衡不移动,C气体的浓度为1mol/L,实际C的浓度变为0.9mol/L,说明平衡向逆反应方向移动,
A.C的物质的量浓度减小了,所以其体积分数减小,故A错误;
B、保持温度不变,将容器的体积缩小1倍,如平衡不移动,C气体的浓度为1mol/L,实际C的浓度变为0.9mol/L,说明平衡向逆反应方向移动,故B错误;
C.平衡逆向移动,反应物转化率降低,故C错误;
D.保持温度不变,将容器的体积缩小1倍,平衡向逆反应方向移动,说明反应物气体物质的量比生成物小,a+b<c+d,故D正确;
故选D.
点评 本题考查了化学平衡的影响因素,题目难度中等,明确化学平衡及其影响因素为解答关键,注意“将密闭容器的体积缩小为$\frac{1}{2}$,再达平衡时,测得C气体的浓度为0.9mol/L”实际上C的浓度减小了,为易错点,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | SO2、H2S、Cl2 | B. | SO2、O2、NH3 | C. | HCl、HBr、HI | D. | SO2、CO2、O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “甘之如饴”说明糖类均有甜味 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
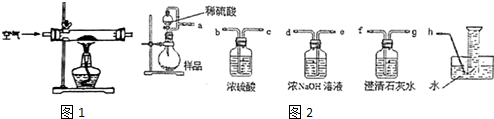
| 实验方案 | 产生的现象 |
| Ⅰ.取烧瓶中的反应液加入少量Mn02粉末 | 有大量气泡逸出 |
| Ⅱ.向NaOH稀溶液中加入2〜3滴酚酞试液,然后加入少量的反应液 | 溶液先变红后褪色 |
| Ⅲ.向反应液中加入2〜3滴酚酞试液,充分振荡,然后逐 滴加入过量的NaOH稀溶液 | 开始无明显现象.加NaOH溶 液先变红后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
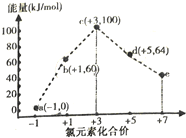
| A. | e是ClO3- | |
| B. | b→a+c反应的活化能为60kJ•mol-1 | |
| C. | a,b,c,d,e中c最稳定 | |
| D. | b→a+d反应的热化学方程式为3ClO-(aq)═ClO3-(aq)+2Cl-(aq)△H=-116kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0
已知水溶液中CrO42-(黄色)和 Cr2O72-(橙色)间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O△H<0查看答案和解析>>
科目:高中化学 来源: 题型:解答题
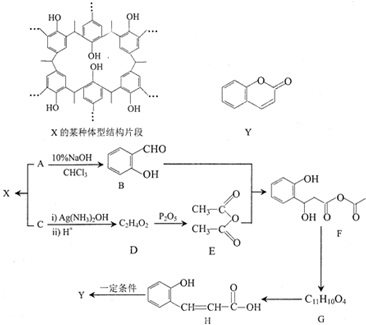
 +H2O→RCOOH+R′COOH
+H2O→RCOOH+R′COOH 中的官能团名称为醛基、羟基
中的官能团名称为醛基、羟基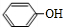 ,DCH3COOH,G
,DCH3COOH,G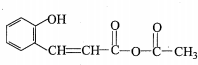

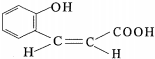
 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式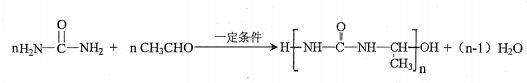
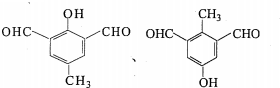 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 时间/min | 0 | 10 | 20 | 30 | 40 |
| 总压强/100kPa | 1.0 | 1.2 | 1.3 | 1.4 | 1.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
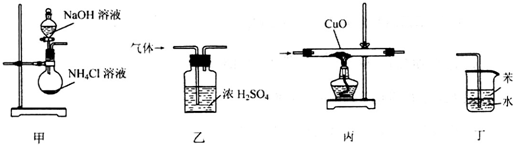
| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收尾气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com