
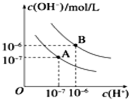
 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示:分析 (1)水的电离是吸热过程,降低温度抑制水电离,导致水中c(H+)、c(OH-)都减小;
(2)100℃时水的电离平衡曲线为B,带入KW=c(H+)•c(OH-)计算,氯化钠溶液呈中性,该温度下pH=-lgc(H+)计算,根据c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$和pH=-lgc(H+)计算该温度下0.01mol/L NaOH溶液的pH;
(3)氨水中加入少量氯化铵固体,增大了c(${NH}_{4}^{+}$),平衡向左移动,溶液中氢氧根离子浓度降低、一水合氨浓度增大,所以此时溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$变小.
解答 解:(1)水的电离是吸热过程,升高温度,使水的电离程度增大,当温度升高时,促进水的电离,水的离子积增大,水中氢离子、氢氧根离子浓度都增大,因此25℃时水的电离平衡曲线是A,100℃时水的电离平衡曲线为B,
故答案为:A;
(2)100℃时水的电离平衡曲线为B,KW=c(H+)•c(OH-)=10-6×10-6=10-12,氯化钠溶液呈中性,该温度下pH=-lgc(H+)=-lg10-6=6,该温度下0.01mol/L NaOH溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-12}}{0.01}$mol/L=10-10mol/L,pH=-lgc(H+)=-lg10-10=10,
故答案为:10-12;6;10;
(3)NH3•H2O?NH4++OH-,氨水中加入少量氯化铵固体,增大了c(${NH}_{4}^{+}$),平衡向左移动,导致溶液中氢氧根离子浓度降低、一水合氨浓度增大,所以此时溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减小,
故答案为:向左;减小.
点评 本题考查了水的电离和弱电解质电离,根据弱电解质的电离特点来分析解答,注意不同电解质溶液PH的计算方法,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将盐卤或石膏加入豆浆中,制成豆腐 | |
| B. | 一支钢笔使用两种不同型号的蓝黑墨水,易出现堵塞 | |
| C. | 三氯化铁溶液中滴稀氨水出现红褐色沉淀 | |
| D. | 清晨,人们经常能看到阳光穿过茂密的树木枝叶所产生的美丽景象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol Cu在适量硫蒸气中燃烧,得到的固体质量为80g | |
| B. | 分子数为NA的CO、C2H4的混合气体体积约为22.4L,质量为28g | |
| C. | 56g Fe投入足量冷的浓硝酸中,转移的电子数为3NA | |
| D. | 0.lmol1${\;}_{53}^{131}$I原子中含电子数为7.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 杂质 | 试剂 | 主要操作 | |
| A | NaHCO3 | Na2CO3 | 盐酸 | 加热 |
| B | SiO2 | Fe2O3 | 盐酸 | 过滤 |
| C | I2 | H2O | 乙醇 | 萃取 |
| D | H2O | Fe3+ | NaOH | 过滤 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH(C2H5)CH2CH2CH3 2-乙基戊烷 | |
| B. | CH2=CH(CH3)C=CH2 2-甲基-1,3-二丁烯 | |
| C. | CH2(OH)CH2CH2CH2OH 1,4-二羟基丁醇 | |
| D. | CH3CH2CHClCCl2CH3 2,2,3-三氯戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热蒸发K2CO3溶液的方法获得K2CO3晶体 | |
| B. | 用Na2S溶液和Al2(SO4)3溶液反应制取Al2S3固体 | |
| C. | 用Na2S溶液和CuSO4溶液反应无法制取CuS固体 | |
| D. | 加热MgCl2溶液制取MgCl2固体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com