解:(1)制备过程发生的反应为:造气,二氧化硫的生成:4FeS
2+11O
2═2Fe
2O
3+8SO
2;氧化,二氧化硫的催化氧化:2SO
2+O
2
2SO
3;三氧化硫的吸收:SO
3+H
2O═H
2SO
4;
故答案为:二氧化硫的生成,二氧化硫催化氧化;三氧化硫的吸收;
(2)增大压强后,SO
2的平衡转化率提高得并不多,加压对设备的要求高且耗能多,将增大投资和能量消耗.400℃~500℃作为操作温度,因为在这个温度范围内,催化剂的活性(反应速率)和SO
2的平衡转化率都比较理想.故选择400℃~500℃,1MPa大气压.故答案为:400℃~500℃,1MPa大气压;
(3)A、恒温恒容通入与平衡无关的气体,总压增大,分压不变,平衡不动,二氧化硫转化率不变;故A错误;
B、增加空气的量,反应物浓度增大,反应速率增大,会使平衡正向进行,提高了二氧化硫的转化率;故B正确;
C、催化剂只改变速率不改变平衡,不改变转化率;故C错误;
D、降低温度,及时转移SO
3 可以使平衡正向进行,二氧化硫转化率增大,但降温反应速率减小,故D错误;
故选B.
(4)在硫酸工业尾气中,SO
2是主要大气污染物,也是酸性氧化物,进行净化处理时可以用碱液吸收,如NaOH、氨水、石灰水等,生成亚硫酸盐,然后再用硫酸处理,重新生成SO
2和一种生产水泥的辅料,则碱液可选择石灰水,反应为SO
2+Ca(OH)
2═CaSO
3↓+H
2O、CaSO
3+H
2SO
4═CaSO
4+SO
2↑+H
2O,
故答案为:石灰水;SO
2+Ca(OH)
2═CaSO
3↓+H
2O、CaSO
3+H
2SO
4═CaSO
4+SO
2↑+H
2O;
(5)进入第二阶段设备气体的体积分数为:SO
27%、O
211%、N
282%.现有100体积这样的混合气体在反应后变成为96.7体积,反应后气体体积减少100-96.7=3.3;反应后混合气体中N
2和SO
3的体积比结合化学方程式中反应后气体体积变化计算为:
2SO
2+O
2
2SO
3;△V
2 1 2 1
6.6 3.3 6.6 3.3
剩余气体体积为:96.7,其中含有三氧化硫体积为6.6,二氧化硫体积=7-6.6=0.4,氧气11-3.3=7.7,氮气体积=82,反应后混合气体中N
2和SO
3体积比=82:6.6=410:33;
二氧化硫的转化率=
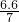
×100%=94.3%
故答案为:410:33;94.3%
分析:(1)依据工业制硫酸的工艺流程分析回答;
(2)增大压强后,SO
2的平衡转化率提高得并不多,加压对设备的要求高且耗能多,将增大投资和能量消耗.400℃~500℃作为操作温度,因为在这个温度范围内,催化剂的活性(反应速率)和SO
2的平衡转化率都比较理想;
(3)提高反应速率和SO
2的转化率,依据影响化学反应速率和化学平衡移动方向判断;
(4)硫酸工业尾气中SO
2净化处理方法很多,SO
2是酸性氧化物,因此常用碱液吸收,如氨水、氢氧化钠溶液、石灰水等;
(5)依据化学方程式,结合反应前后体积差量计算;
点评:本题考查了工业制硫酸的生成过程和反应特征,二氧化硫的催化氧化反应的条件选择,尾气吸收的方法判断,二氧化硫接触室催化氧化反应的定量计算,题目难度中等.

 2SO3;三氧化硫的吸收:SO3+H2O═H2SO4;
2SO3;三氧化硫的吸收:SO3+H2O═H2SO4; 2SO3;△V
2SO3;△V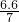 ×100%=94.3%
×100%=94.3%

 出彩同步大试卷系列答案
出彩同步大试卷系列答案 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿 5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿
5Ca2+(aq)+3PO43-(aq)+OH-(aq)向右移动,导致Ca5(PO4)3OH溶解,造成龋齿