
分析推理是化学学习的方法之一。下列实验推理中,正确的是 ( )
A.金属的冶炼方法与金属的活泼性有很大关系,所以铁、锌等金属一般用热还原法冶炼
B.钠比铜活泼,所以钠可以从硫酸铜溶液中置换出铜
C.工业上电解熔融氯化镁可制得金属镁,所以工业上电解熔融氯化铝可制得铝
D.将镁条和铝片用导线连接后插进稀NaOH溶液中,镁条上产生气泡,说明铝比镁活泼
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值。下列叙述中不正确的是
A、分子总数为NA的NO2和CO2混合气体中含有的氧原子数为2NA
B、28g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA
C、常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA
D、常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子数为2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法正确的是
A.微粒半径:Z2+>W2->R-
B.对应氢化物的稳定性:W>R
C.W与X、W与Z形成的化学物晶体类型相同
D.Y的最高价氧化物对应的水化物是弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定的溶液中能大量共存的是( )
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
⑥强酸性溶液中:Fe2+、Al3+、NO3-、Cl-
A.①②⑤ B.②④⑥ C.②④ D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上把Cl2通入冷NaOH溶液中制得漂白液(主要成分NaClO)。一化学小组在室温下将氯气缓缓通入NaOH溶液,模拟实验得到ClO-、ClO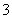 等离子其物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是( )
等离子其物质的量(mol)与反应时间t(min)的关系曲线。下列说法错误的是( )
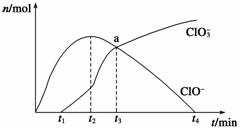
A.工业制取漂白液的化学反应方程式为Cl2+2NaOH===NaCl+NaClO+H2O
B.a点时溶液中各离子浓度:c(Na+)>c(Cl-)>c(ClO3-)=c(ClO-)>c(OH-)>c(H+)
C. t2~t4,ClO-离子的物质的量下降的原因可能是3ClO-= 2Cl-+ClO3-
D.使用漂白液时,为了增强漂白效果,可以向漂白液中加入浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
已知酸性条件下有反应:2Cu+ Cu2++Cu。氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。某同学对某次氢气还原氧化铜的红色固体产物做了如下实验,实验操作和实验现象列表如下:
Cu2++Cu。氢气还原氧化铜实验由于反应温度不同,可能产生Cu或Cu2O,两者都是红色固体。某同学对某次氢气还原氧化铜的红色固体产物做了如下实验,实验操作和实验现象列表如下:
| 加入试剂 | 稀硫酸 | 浓硫酸 并加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体 不反应 | 无色气体 | 无色气体 蓝色溶液 | 红棕色气体 蓝色溶液 |
由此推出本次氢气还原氧化铜实验的产物( )
A.是Cu
B.是Cu2O
C.一定有Cu,一定有Cu2O
D.一定有Cu2O,可能有Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系。下列条件下关于离子存在的说法中正确的是
A.a点对应的溶液中大量存在:Na+、Ba2+、Fe3+、Cl-
B.b点对应的溶液中大量存在: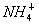 、K+、I-、
、K+、I-、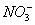
C.c点对应的溶液中大量存在: Cu2+、Na+、Cl-、S2-
 D.d点对应的溶液中大量存在:K+、AlO2-、ClO-、Cl-
D.d点对应的溶液中大量存在:K+、AlO2-、ClO-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
常温时,Ksp[Mg(OH)2] = 1.1×10-11,Ksp(AgCl) = 1.8×10-10,Ksp(Ag2CrO4) = 1.9×10-12,
Ksp(CH3COOAg) = 2.3×10-3,下列叙述不正确的是
A.浓度均为0.2 mol·L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生
CH3COOAg沉淀
B.将0.001 mol·L-1的AgNO3溶液滴入0.001 mol·L-1的KCl和0.001 mol·L-1的K2CrO4
溶液中,先产生Ag2CrO4沉淀
C.c(Mg2+)为0.11 mol·L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
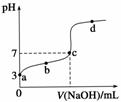 已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
A.a点表示的溶液中c(CH3COO-)略小于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中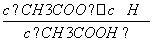 均等于K
均等于K
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com