
| ��ѧ�� | C-C | C-H | H-H | C-O | C=O | H-O |
| ����/kJ•mol-1 | 348 | 414 | 436 | 326.8 | 1032 | 464 |
���� ��1�����ݻ�ѧ��Ӧ�ʱ�=��Ӧ������ܺ�-����������ܺͼ��㣬��ע���ʾۼ�״̬�Ͷ�Ӧ��Ӧ���ʱ�д���Ȼ�ѧ����ʽ��
��2���٢���2H2��g��+CO��g��?CH3OH��g����H1=-128.8 kJ•mol-1
����2CH3OH��g��?CH3OCH3��g��+H2O��g����H2=-23.5kJ•mol-1
����CO��g��+H2O��g��?CO2��g��+H2��g����H3=-41.3kJ•mol-1
���ݸ�˹���ɼ���ii+iii+i��2�õ���Ӧ���Ȼ�ѧ����ʽ��
�ڷ�Ӧ�ﵽƽ��״̬�ı�־�����淴Ӧ������ͬ������ֺ������ֲ����Լ������ĸ��ֹ�ϵ�����������DZ��ʣ�
�۷�Ӧ�ﵽƽ�⣬Ҫ���CO��ת���ʻ�ѧƽ��������У�
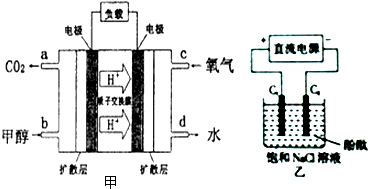
��3�������������£������ϼ״�ʧ���Ӻ�ˮ��Ӧ���ɶ�����̼�������ӣ����������õ������������ӷ�Ӧ����ˮ���ݴ�д���缫��Ӧʽ��
��ͼ��װ�õ�ⱥ��ʳ��ˮ��C1��C2��Ϊʯī�缫�����÷�Ӧ����Һ����������C2�缫�õ���������������ˮ����ƽ��������У�����������Ũ��������������C1�缫ʧ��������������
�����ݵ缫��Ӧ�����غ���㣬ԭ��ظ����缫��ӦCH3OH+H2O-6e-�TCO2+6H+���͵��������缫��Ӧ2H++2e-=H2�����ڵ����غ㣻
��� �⣺����1��CO��g��+2H2��g��?CH3OH ��g������Ӧ���ʱ���Ը��ݷ�Ӧ����ܼ��ܺ���������ܼ��ܼ���õ����ʱ�=��Ӧ���ܼ���֮��-�������ܼ���֮�ͣ�����ͼ���ṩ�Ļ�ѧ���ļ��ܼ���õ�����H1�T1032KJ/mol+2��436KJ/mol-��3��414KJ/mol+326.8KJ/mol+464KJ/mol��=-128.8 kJ•mol-1��
�ʴ�Ϊ��-128.8��
��2���٢���2H2��g��+CO��g��?CH3OH��g����H1=-128.8 kJ•mol-1
����2CH3OH��g��?CH3OCH3��g��+H2O��g����H2=-23.5kJ•mol-1
����CO��g��+H2O��g��?CO2��g��+H2��g����H3=-41.3kJ•mol-1
���ݸ�˹���ɼ���ii+iii+i��2�õ���Ӧ���Ȼ�ѧ����ʽ��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g����H=-322.4KJ/mol��
�ʴ�Ϊ��-322.4��
��3H2��g��+3CO��g��?CH3OCH3��g��+CO2��g����H=-322.4KJ/mol���ܷ�Ӧ�����������С�ķ��ȷ�Ӧ��
A��c��H2����c��CO����c��CH3OCH3����c��CO2����Ϊ0.1mol•L-1 ������֤�����淴Ӧ������ͬ������˵����Ӧ�ﵽƽ��״̬����A����
B����Ӧ����֮�ȵ��ڻ�ѧ����ʽ������֮�ȣ�Ϊ����Ӧ����֮�ȣ���v��H2����=3v��CH3OCH3���� ʱ���������淴Ӧ������ͬ��Ӧ�ﵽƽ��״̬������
2v��H2����=v��CH3OCH3����������˵����Ӧ�ﵽƽ��״̬����B����
C����Ӧǰ���������ʵ����仯���������������ѹǿ���ֲ���˵����Ӧ�ﵽƽ��״̬����C��ȷ��
D����λʱ��������n mol CO��ͬʱ����n mol H2��˵����Ӧ������У�����˵����Ӧ�ﵽƽ��״̬����D����
�ʴ�Ϊ��C��
��a��ѹǿ����ƽ��������Ӧ�����ƶ���COת��������a��ȷ��
b��������������Ӧ���ʣ����ı仯ѧƽ�⣬COת���ʲ��䣬��b����
c������CO2��Ũ��ƽ��������Ӧ��Ӧ�ƶ���COת��������c��ȷ��
d������CO��Ũ�ȣ�CO��ת���ʷ�����С����d����
e�������������ƽ��������Ӧ��Ӧ�ƶ���COת��������e��ȷ��
�ʴ�Ϊ��a c e��
��3�������������£������ϼ״�ʧ���Ӻ�ˮ��Ӧ���ɶ�����̼�������ӣ����ĵ缫��ӦʽΪ��CH3OH+H2O-6e-�TCO2+6H+��
���������õ����ӽ�������ӷ�Ӧ����ˮ�������缫��ӦʽΪ��4H++4e-+O2=2H2O��
�ʴ�Ϊ��O2+4H++4e-=2H2O��
��ͼ��װ�õ�ⱥ��ʳ��ˮ��C1��C2��Ϊʯī�缫�����÷�Ӧ����Һ��������������C2�缫�õ���������������ˮ����ƽ��������У�����������Ũ��������Һ�з�̪���ɫ��������������C1�缫ʧ����������������Ӧ�����ӷ���ʽΪ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+Cl2��+H2����
�ʴ�Ϊ��2Cl-+2H2O$\frac{\underline{\;���\;}}{\;}$2OH-+Cl2��+H2����C2��
��ԭ��ظ����缫��ӦCH3OH+H2O-6e-�TCO2+6H+���͵��������缫��Ӧ2H++2e-=H2�����ڵ����غ㣬CH3OH��3H2����6e-������8g�״���ȫ��Ӧ���ʵ���=$\frac{8g}{32g/mol}$=0.25mol����C2�Ͽ��ռ�����״������������=0.25mol��3��22.4L/mol=16.8L��
�ʴ�Ϊ��16.8L��
���� ���⿼���˻�ѧƽ��Ӱ�����ء�ƽ���־��ԭ��غ͵��ع���ԭ������Ӧ�á��Ȼ�ѧ����ʽ���Ե�֪ʶ����Ŀ�Ѷ��еȣ�����֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ���ѧ���ķ������������������Ӧ�û���֪ʶ��������ע��ԭ��غ͵��ع���ԭ���еĵ����غ�Ӧ�ú��Ȼ�ѧ����ʽ����дԭ��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | M��N | B�� | M��N | C�� | M=N | D�� | ����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��1 | B�� | 2��5 | C�� | 5��2 | D�� | 2��3 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������� | B�� | ���� | C�� | Ư�۾� | D�� | ��ˮ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 100mL��Ͳ | B�� | ������ | C�� | ������ƽ | D�� | 50mL����ƿ | ||||
| E�� | 10mL��Ͳ | F�� | ��ͷ�ι� | G�� | 50mL�ձ� | H�� | 100mL����ƿ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | MgCl2 �����ʵ���Ũ��Ϊ0.5mol•L-1 | |
| B�� | Cl-�ĸ���Ϊ3.01��1023 | |
| C�� | Mg2+�����ʵ���Ϊ2mol | |
| D�� | Cl-�����ʵ���Ũ��Ϊ2mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ϩ�ͱ���������ˮ��Ӧ | |
| B�� | ���顢��ϩ�ͱ��ڹ�ҵ�϶���ͨ��ʯ�ͷ���õ� | |
| C�� | �л�������ж�����̼̼���� | |
| D�� | �Ҵ����Ա�����Ϊ���ᣬ���߶��ܷ���������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2+3Mg$\frac{\underline{\;��ȼ\;}}{\;}$Mg3N2 | B�� | N2+3H2$?_{����}^{���¡���ѹ}$2NH3 | ||
| C�� | 2NO+O2�T2NO2 | D�� | N2+O2$\frac{\underline{\;�ŵ�\;}}{\;}$2NO |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
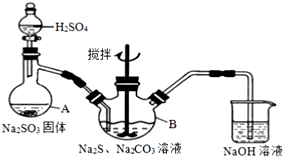 ��������ƣ�Na2S2O3����һ����Ҫ�Ļ�����Ʒ��ij��ȤС���ڲ������Ϻ��Ʊ�Na2S2O3����������ʽ�����ʵ��̽����
��������ƣ�Na2S2O3����һ����Ҫ�Ļ�����Ʒ��ij��ȤС���ڲ������Ϻ��Ʊ�Na2S2O3����������ʽ�����ʵ��̽�����鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com