
| A. | 1句 | B. | 2句 | C. | 3句 | D. | 4句 |
分析 ①锂与氧气反应只生成氧化锂;
②相同条件下,Na2CO3的溶解度大于NaHCO3;
③Pb在化合物里显+2价或+4价,根据化合价代数和为零的原则写出Pb的两种氧化物形式;
④三价铁离子具有强的氧化性,能够氧化硫离子;
⑤浓硫酸、浓硝酸都具有强的氧化性,常温下能够使铁铝钝化;
⑥依据阴极阳离子放电顺序解答.
解答 解:①锂与氧气反应只生成氧化锂,得不到过氧化锂,故错误;
②相同条件下,Na2CO3的溶解度大于NaHCO3,CaCO3的溶解度小于Ca(HCO3)2,故错误;
③Pb在化合物里显+2价或+4价,根据化合价代数和为零的原则写出Pb的两种氧化物形式为:PbO和PbO2,那么Pb2O3的氧化物的表示形式可以写成 2PbO•PbO2,故错误;
④Al3+与S2-在溶液中可发生双水解反应生成沉淀和气体,Fe3+和S2-发生氧化还原反应,故错误;
⑤浓硫酸、浓硝酸都具有强的氧化性,常温下能够使铁铝钝化,可以用铝制或铁制容器常温下贮运浓硫酸和浓硝酸,故正确;
⑥电解CuCl2溶液阴极析出Cu,电解AlCl3溶液阴极上析出的是氢气,故错误;
故选:A.
点评 本题考查类推这一思维方法在化学学科中的应用,属于方法与知识相结合的内容,明确物质的性质是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 由①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(1)的△H大于△H1 | |
| B. | 等物质的量的甲烷分别发生①②反应至完全,转移的电子数不同 | |
| C. | 若用0.2 mol CH4发生上述反应还原足量的NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 LCH4还原足量的NO2至N2,整个过程中转移的电子的物质的量为16 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

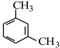 ;
;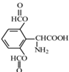 、
、 ;
; +CH3CH=CH2$\stackrel{AlCl_{3}}{→}$
+CH3CH=CH2$\stackrel{AlCl_{3}}{→}$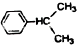 结合相关信息,请写出以
结合相关信息,请写出以 、CH2=CH2和
、CH2=CH2和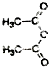 为原料制备
为原料制备 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去Mg粉中混有的Al粉:加入足量的氨水,过滤 | |
| B. | 除去BaCO3固体中混有的BaSO4:加入过量盐酸后,过滤、洗涤 | |
| C. | 除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 | |
| D. | 从I2的四氯化碳溶液中分离出I2:分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
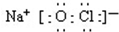 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com