
【题目】利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列说法正确的是

A. a为直流电源的负极
B. 阴极的电极反应式为:2HSO3-+2H2O+2e-=S2O42-+2OH-
C. 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+
D. 电解时,H+由阴极室通过阳离子交换膜到阳极室
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用与封存是我国能源领域的一个重要战略方向,发展成一项重要的新兴产业。
(1)已知:CH4、CO、H2的燃烧热分别为890 kJmol-1、283 kJmol-1、285.8 kJmol-1,计算下列反应的反应热。CO2(g)+CH4(g)= 2CO(g)+ 2H2(g) ΔH=____kJmol-1。
(2)利用废气中的CO2为原料制取甲醇,反应方程式为:CO2+3H2![]() CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
CH3OH+H2O其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CO2的转化率随反应温度的变化如图1所示。
①该反应的ΔH______0(填“>”或“<”)
②d点不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下CO2的转化率相同的原因是_______________。


(3)用二氧化碳催化加氢来合成低碳烯烃,起始时以0.1MPa,n(H2)∶n(CO2)=3∶1的投料比充入反应器中,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
C2H4(g)+4H2O(g)△H,不同温度下平衡时的四种气态物质的物质的量如图2所示:
①该反应在__________自发进行(填“低温”或“高温”)。
②c代表的物质是_______________。
③T1温度下的平衡转化率为__________________,相对于起始状态,平衡时气体的平均相对分子质量增大的百分率为_______________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲烷在一定条件下可生成以下微粒:
A. 碳正离子(CH3+ ) B.碳负离子(CH3—)C. 甲基 (﹣CH3) D.碳烯 (:CH2)
①四种微粒中,键角为120°的是_____(填序号).
②碳负离子(CH3—)的空间构型为______,与CH3—互为等电子体的一种分子是__(填化学式)
(2)在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学方程式为(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3=Cu(NH3)3(CO)Ac.请回答下列问题:
①该反应中含有的第二周期非金属元素的第一电离能由大到小的顺序为_________.
②写出基态Cu2+的价电子排布式_____________.
③化合物Cu(NH3)3(CO)Ac中,金属元素的化合价为___________.
④在一定条件下NH3和CO2能合成尿素CO(NH2)2,尿素中C原子轨道的杂化类型为__;1mol尿素分子中,σ 键的数目为______________.
⑤Cu与O元素形成的某种化合物的晶胞结构如图所示,若阿伏伽德罗常数为NA,晶胞的边长为a pm,则氧元素对应的离子在该晶胞中的坐标是_____,该晶体的密度为__gcm﹣3.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
(一)硒元素(selenium)是第四周期、第VIA族元素,单质有红硒、黑硒和灰硒,其中灰硒有良好的导热导电性,且有显著的光电效应,可应用于光电半导体材料。请回答下列问题:
(1)Se原子的核外电子排布式为[Ar]_____。
(2)As和Se是同一周期的元素,As的第一电离能比Se大,原因是______。SeO42-中Se―O的键角比SeO3的键角________(填“大”或“小”)。
(3)H2Se比H2S水溶液的酸性强,原因是_____,____。
(4)灰硒的晶体为六方晶胞结构,原子排列为无限螺旋链,分布在六方晶格上,同一条链内原子作用很强,相邻链之间原子作用较弱,其螺旋链状图、晶胞结构图和晶胞俯视图如下。

螺旋链中Se原子的杂化方式为____________。
(二)利用CuSO4和NaOH制备的Cu(OH)2检验醛基时,生成红色Cu2O,其晶胞结构如图所示。

①该晶胞原子坐标参数A为(0,0,0);B为(1,0,0);C为(1/2,1/2,1/2)。则D原子的坐标参数为_________,它代表铜原子。
②若Cu2O晶体密度为d g·cm-3,晶胞参数为a pm,则阿伏加德罗常数值NA=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氢氧化铁胶体中逐滴滴入下列某种溶液,出现的现象是先沉淀后沉淀溶解。这种溶液是
A.稀硫酸 B.饱和硫酸镁溶液
C.氯化钡溶液 D.饱和硫酸铵溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质按照纯净物、混合物、电解质和非电解质顺序排列的是( )
A. 盐酸、天然气、醋酸、干冰 B. 胆矾、漂白粉、氯化钾、氯气
C. 氯化钠、福尔马林、硫酸钠、乙醇 D. 单甘油酯、混甘油酯、苛性钾、石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由二氧化硅制高纯硅的流程如下,下列判断中错误的是
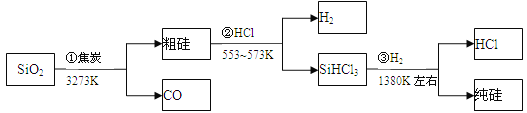
A. ①②③均属于氧化还原反应 B. H2和HCl均可循环利用
C. SiO2是一种坚硬难熔的固体 D. SiHCl3摩尔质量为135.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、R、T的原子半径与原子序数关系如下图所示。R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的化合物Z2T能破坏水的电离平衡。下列推断正确的是

A. 原子半径和离子半径均满足:Y<Z
B. 氢化物的沸点不一定是:Y>R
C. 最高价氧化物对应水化物的酸性:T<R
D. 由X、R、Y、Z四种元素组成的化合物水溶液一定显碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com