
| A. | 向含有FeBr2的溶液中通入过量Cl2充分反应:2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 | |
| B. | Ca(HCO3)2溶液中加入少量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+H2O | |
| C. | 磁性氧化铁溶于稀硝酸:3 Fe2++4H ++NO3-═3Fe3++NO↑+3H2O | |
| D. | 明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2 SO42-═2BaSO4↓+Al(OH)3↓ |
分析 A.通入过量Cl2,亚铁离子、溴离子均被氧化;
B.加入少量NaOH溶液,生成碳酸钙、水、碳酸氢钠;
C.磁性氧化铁为四氧化三铁,在离子反应中保留化学式,且发生氧化还原反应;
D.使SO42-恰好完全沉淀,明矾与Ba(OH)2以1:2反应,生成硫酸钡、偏铝酸钾.
解答 解:A.向含有FeBr2的溶液中通入过量Cl2充分反应的离子反应为2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2,故A正确;
B.Ca(HCO3)2溶液中加入少量NaOH溶液的离子反应为Ca2++HCO3-+OH-═CaCO3↓+H2O,故B错误;
C.磁性氧化铁溶于稀硝酸的离子反应为3 Fe3O4+28H ++NO3-═9Fe3++NO↑+14H2O,故C错误;
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀的离子反应为2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选A.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应、离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品腐蚀时既可作正极也可作负极 | |
| B. | 铁制品腐蚀时铁电极发生反应为:Fe-3e-=Fe2+ | |
| C. | 铁制品腐蚀时或发生析氢腐蚀或发生吸氧腐蚀 | |
| D. | 铁制品连接电源正极可防止腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
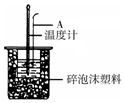 50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.
50mL 0.50mol/L盐酸跟50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算反应热.| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入过量的Ba(OH)2溶液时:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| B. | 溶液恰好呈中性时:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | SO42-离子恰好完全沉淀时:Al3++SO42-+Ba2++4OH-═AlO2-+BaSO4↓+2H2O | |
| D. | 明矾与Ba(OH)2按物质的量比1:1反应时:Al3++SO42-+Ba2++3OH-═Al(OH)3↓+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酒精灯在桌上歪倒失火后,立即用湿布盖灭 | |
| B. | 灭火,也用黄沙扑灭 | |
| C. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗 | |
| D. | 不慎将酸溅到眼中,应立即用干布擦去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
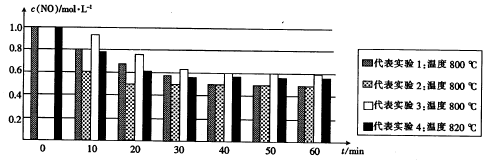
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com