
| A. | 16 | B. | 18 | C. | 20 | D. | 22 |
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Mg2+、Al3+ | B. | Mg2+、Al3+、Cu2+ | C. | Fe3+、Cu2+、Zn2+ | D. | Ag+、Cu2+、Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
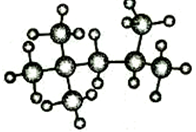 完成下列空白.
完成下列空白.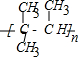 ;
; +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
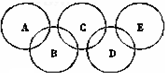 如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:
如图所示五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素;五种化合物由四种短周期元素形成,每种化合物仅含有两种元素.A是工业制取硝酸的主要原料之一;B、E分子中所含电子数都为18,B不稳定,具有较强的氧化性,E是由六个原子构成的分子,可作火箭燃料;C是工业制光导纤维的主要原料;D中所含的两种元素的原子个数之比为3:4.根据以上信息回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,则生成1mol纯硅吸收的热量为0.025aKJ查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素的非金属性:Y>W | |
| B. | 阴离子的还原性:W2->Q- | |
| C. | 离子半径:Y2->Z3+ | |
| D. | Q、W、Y对应的氢化物的沸点逐渐降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;若XY2为共价化合物时,其电子式为:
;若XY2为共价化合物时,其电子式为: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③④⑤ | B. | 只有①③④⑤ | C. | ①②③④⑤ | D. | 只有①②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
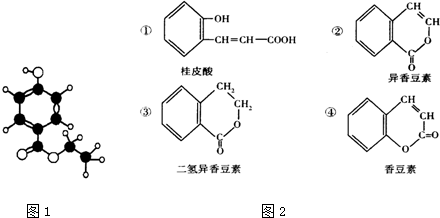
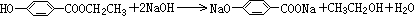 ;
; ;
;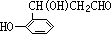 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com